今日,中国器审发布关于公开征求《增材制造聚醚醚酮植入物注册技术审查指导原则(征求意见稿)》意见的通知。
增材制造聚醚醚酮植入物注册技术审查指导原则
(征求意见稿)
一、前言
基于减材制造的聚醚醚酮材料已经广泛用于人体硬组织的重建和修复,增材制造技术在用于聚醚醚酮材料产生了新的临床受益外,也引入了新的风险。本指导原则提出针对增材制造聚醚醚酮植入物的设计研发、生产制造中需要满足的产品基本安全、有效及质量可控通用要求,并不包括产品上市注册所需提交申报资料的所有内容。注册申请人还需结合具体产品,参考我国已发布其他相关技术审查指导原则等相关要求对申报资料内容进行补充和细化。
本指导原则是对注册申请人和审查人员的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行。如果有能够满足相关法规要求的其他方法,也可以采用,但是需要提供详细的研究资料和验证资料。需在遵循相关法规和标准的前提下使用本指导原则。
本指导原则是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准的不断完善,以及科学技术的不断发展,本指导原则相关内容也将进行适时的调整。
二、适用范围
本指导原则适用于采用聚醚醚酮材料经增材制造工艺生产,作用于骨、关节及口腔硬组织的无源植入性个性化医疗器械。指导原则涵盖了产品设计开发和制造全流程中个性化设计开发、增材制造生产制造、性能评价和临床评价等相关内容。
采用以聚醚醚酮为主体的复合材料增材制造的植入产品可在本指导原则要求的基础上进一步完善。
三、基本原则
(一) 患者匹配产品设计研发需以临床需求为导向,首先明确增材制造个性化聚醚醚酮植入物的临床适用范围;
(二) 增材制造聚醚醚酮植入物所使用的材料及其终产品需满足植入医疗器械的生物相容性要求;
(三) 个性化植入物的设计需确保结构适配、力学性能适配和生物功能适配;
(四) 增材制造聚醚醚酮植入物所使用的增材制造设备和工艺需满足要求并具有稳定性;
(五) 需在临床性能确认前对增材制造聚醚醚酮植入物的产品质量和性能进行评价。
四、技术要求
(一) 术语和定义
1.下列标准界定的术语和定义适用于本指导原则
表1. 标准中界定的术语和定义
标准号 标准名称
YY/T 0640-2016 无源外科植入物 通用要求
GB/T 35351-2017 增材制造 术语
2.下列术语和定义适用于本指导原则
2.1个性化医疗器械
包括《定制式医疗器械监督管理规定(试行)》中所述的定制式医疗器械和患者匹配医疗器械。
2.2安全系数
定义为材料的破坏应力与植入物在人体内预期所受最大应力的比值,安全系数任何情况下不得小于1。
2.3均匀材料
局部材料属性不随空间位置变化的材料。
2.4 非均匀材料
与均匀材料相对应,局部材料属性随空间位置变化的材料。
2.5 各向异性
部件的力学性能随着方向的改变有所变化,在不同方向上呈现出差异的性能。
(二) 技术性要求
1. 性能评价
1.1 适用范围
明确产品适用范围,包括使用部位、适用情形、适应症、适用人群、禁忌症。
1.2 结构尺寸
明确产品的结构形式、关键部位的尺寸及公差。产品如包含多孔结构,需提供最小多孔结构单元的确定依据,如孔单元形态、孔径大小及其分布、丝径、孔隙率、平均孔隙截距、孔隙梯度、孔内部连通性、多孔结构的厚度等的质控范围和确定依据。
1.3 制造质量
明确终产品的外观、内部缺陷、表面粗糙度的指标要求、确定依据及可接受性论述。
1.4 理化性能
明确终产品材料的物理和化学性能,可参考YY/T 0660外科植入物用聚醚醚酮(PEEK)聚合物的标准规范中第5部分性能参数,提供验证资料。其中,红外光谱和重金属含量要求不低于上述标准中规定的指标要求。同时,提供全部性能指标要求、指标要求的确定依据及可接受性验证资料。
1.5 机械性能
结合产品预期临床使用,明确植入物各项机械性能的性能要求、确定依据和可接受性验证资料。
1.6 生物相容性
根据GB/T 16886系列标准要求,结合植入物预期临床使用,对终产品满足生物相容性要求进行评价。
1.7 无菌性能
无菌状态供货产品,需明确灭菌工艺(方法和参数)和无菌保证水平,并提供灭菌确认报告。如灭菌方法可能出现残留,需明确残留物质控要求及确定依据,并提供相关验证资料。非无菌状态供货产品,需明确推荐的灭菌工艺(方法和参数)及所推荐灭菌方法的确定依据。
1.8 产品货架寿命和包装
提供包装及包装完整性研究资料。如适用,提供货架寿命验证资料。
2. 临床评价
增材制造聚醚醚酮植入物的临床评价可依据现行法规和规范性文件要求开展。
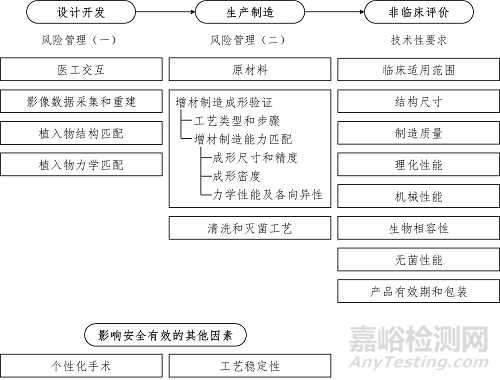
(三) 风险管理
1. 设计开发风险与质控
1.1 医工交互
设计开发中医工交互过程的风险,例如医学团队不能掌握工程团队的制造能力,或工程团队在设计中难以理解医学需求等。为避免此类的风险,注册申请人需按照《个性化匹配骨植入物及工具医工交互质控审查指导原则》对增材制造聚醚醚酮植入物的设计开发中医工交互全流程进行质量控制,确保设计开发中各个环节的可追溯性,建议注册申请人及企业建立互联网交互平台实现设计开发中的医工交互及其可追溯性;
1.2 影像数据采集和重建
注册申请人需根据《无源植入性骨、关节及口腔硬组织个性化增材制造医疗器械注册技术审查指导原则》明确医学影像采集使用的软硬件设备及采集和重建过程的关键要素。其中,CT数据采集需明确切片间距/层数、扫描层厚、单层分辨率/像素数、视野和体位;三维重建需明确阈值分割、图像修正(如降噪、平滑、填充等)、被简化或省略的几何特征及其原因。
1.3 植入物结构匹配
建议根据GB/T 12417.1-2018《无源外科植入物骨接合与关节置换植入物第1部分骨接合植入物特殊要求》第4.1节所述功能特性,对植入物的结构与功能特性进行描述。包括但不限于以下方面:
①植入物是否完全覆盖病损或肿瘤区域并有预留空间;
②植入物与手术拟切除部位的匹配性;
③植入物能否恢复患者的外形;
④植入物是否为自体骨/异体骨或其他填充材料预留了空间;
⑤植入物设计是否考虑了与周围骨组织和其他组织结构的连接和固定;
⑥植入物设计是否存在缺陷,如:引发积液风险。
1.4 植入物力学匹配
注册申请人需对植入物的强度进行验证。对于患者匹配产品,植入物的强度验证需涵盖其注册申报的所有尺寸范围。可通过有限元分析、等效模型台架试验或二者结合的形式验证植入物的强度。有限元分析报告中需根据植入物的解剖位置、应用范围、使用条件、预期性能、预期寿命和失效后果,明确植入物的额定安全系数及其评判方式。鉴于植入物种类的多样化,注册申请人需自行提供个性化植入物的安全系数计算报告及额定安全系数的取值依据。对于不同类型植入物,建议安全系数的计算原理如下:对于替代部分骨骼、长期直接承担人体载荷的植入物,需以材料的疲劳极限为破坏应力进行安全系数计算;对于短期承担部分人体载荷或不直接替代承载骨骼的植入物,以材料的屈服极限或强度极限为破坏应力进行安全系数计算。有限元模型的建立和分析方法建议遵照《定制式个性化骨植入物等效性模型注册技术审查指导原则》和《骨科金属植入物有限元分析资料注册技术审查指导原则》。
在植入物强度的研究资料中,明确植入物在人体内与骨或其他组织结构之间的即刻和远期固定方式,并证明连接方式的可靠性。建议在植入物的强度分析中对连接部件的安全性予以体现,或单独验证连接部件的可靠性。
此外,由于增材制造产品在性能调控方面的优势和特殊性,需在有限元分析或等效模型中考虑周围骨骼的材料属性、植入物的均匀材料属性或非均匀材料属性并给出说明。
1.5 个性化设计优化和验证
增材制造聚醚醚酮植入物的设计开发可能需通过有限元分析方法对植入物的结构进行优化设计和强度验证,其风险主要来自于模型与实际情况的差异性以及模型的误差,包括但不限于:
①有限元模型的几何模型、材料属性、边界条件、载荷、接触属性等要素与植入物在体内的实际力学环境的一致性与差异性;
②对于增材制造产品,力学性能各向异性不可避免且在设计中难以预知,可能会导致在实际服役过程中沿力学性能薄弱方向破坏或失效;
③有限元模型的数值误差。
2. 生产制造风险
2.1 原材料
增材制造聚醚醚酮植入物的原材料风险包括:
①所使用的原材料是否满足植入医疗器械的生物相容性要求;
②在不同增材制造工艺中,聚醚醚酮原材料的其他理化性能的稳定性可能带来风险,例如挤出成形工艺中的熔体流动速率、粉末床熔融工艺中的粉末流动性;
③原材料在成分、理化性能和生物相容性的批次稳定性。
需选用与增材制造工艺匹配的聚醚醚酮原材料,可能为丝材、粒料或粉末。提供原材料物理和化学性能质控要求、确定依据和验证资料,至少包括YY/T 0660-2008《外科植入物用聚醚醚酮(PEEK)聚合物的标准规范》中表1中红外光谱、重金属总量、黏度和相变温度参数和要求。粉末需至少包括外观、颗粒形貌、松装密度、振实密度、流动性。
2.2 增材制造成形验证
2.2.1 工艺类型和步骤
需根据GB/T 35351-2017《增材制造术语》要求明确所使用的增材制造工艺类型,目前常用的工艺方法有材料挤出增材制造工艺和粉末床熔融增材制造工艺,材料挤出工艺的典型代表为熔融沉积成形。同时,明确后处理(热处理、机械处理等)各步骤的工序。
2.2.2 增材制造能力匹配
①成形尺寸和精度
成形尺寸和精度需要满足产品设计要求。精度测试可根据GB/T 39329-2020《增材制造测试方法标准测试件精度检验》所规定内容实施。尺寸和精度测试应选取能够代表申报产品规格尺寸范围的最差情形的标准试样进行测试。考虑到聚合物材料增材制造可能出现的翘曲变形,需在拟申报范围中大尺寸、复杂结构上取样。
②成形密度
明确工艺成形实体样件的密度。建议依据GB/T 1033.1-2008《塑料非泡沫塑料密度的测定》进行聚醚醚酮标准试样的密度测试。根据测得密度与YY/T 0660-2008《外科植入物用聚醚醚酮(PEEK)聚合物的标准规范》所述的聚醚醚酮的最大密度相比,其比值为增材制造聚醚醚酮的相对密度。相对密度测试需选取能够代表申报产品规格尺寸范围的最差情形的标准试样进行测试。成形实体样件的密度不低于YY/T 0660中密度要求的95%。
2.2.3 力学性能评价
明确增材制造设备制备的部件需满足制件力学性能要求和确定依据。增材制造逐层叠加原理使制件存在力学性能各向异性,使植入物有在力学性能薄弱方向破坏的风险,评价增材制造聚醚醚酮样件的力学性能时需考虑各向异性问题,并确保结果在可接受范围内。测试项目及方法、样件制备、结果计算和分析详见附录2。
2.3 清洗和灭菌工艺
增材制造聚醚醚酮植入物的灭菌和包装需使用符合YY/T 0640-2016《无源外科植入物通用要求》第9章和第10章的相关规定。
在清洗、灭菌过程中,需考虑包括多孔微结构的产品的孔隙率、比表面积对工艺有效性的影响,提供相应的验证资料。对于以聚醚醚酮为主体的复合材料植入物,还需确认所使用的清洗、灭菌方法对复合材料的适用性。
(四) 影响安全有效的其他因素
1. 个性化手术
植入物在临床应用前可借助数字模型或实物模型对手术植入物过程进行模拟,确保其可植入性。
临床手术风险主要来自于手术植入过程中定位的准确性,手术定位取决于医生操作和配套的个性化模板的使用,因此术前还需考察增材制造聚醚醚酮植入物是否有配套手术工具。
个性化设计由于多种原因可能存在适配性不佳的风险,术中可能需对植入物的外形进行修整,故需配备相应的修整工具。
2. 工艺稳定性
为避免不同批次的增材制造聚醚醚酮植入物的物理、化学和生物学性能变化的风险,需证明制备聚醚醚酮植入物所使用的所有增材制造设备和工艺的稳定性,确保制造过程中不引入杂质。制造装备和工艺的稳定性具体可表现在对于环境、加工精度和性能的控制。
2.1 环境
涉及到医疗器械的生产,所使用聚醚醚酮植入物增材制造设备的加工生产区域(包括增材制造设备的外环境和后处理、组装、包装等)的洁净度需满足《医疗器械生产质量管理规范》的要求,增材制造设备内部的洁净度需不低于加工生产区域,设备内部洁净度需保证长期稳定。
2.2 精度
需对不同批次增材制造精度稳定性进行评测,依据GB/T 39329-2020《增材制造测试方法标准测试件精度检验》在每个校准周期对样件精度进行测试,用后一次测得的精度数据与前一次测得的精度数据之间的相对误差表征增材制造精度均一性。
2.3 性能
需对不同批次的增材制造性能进行验证,依据产品设计的具体性能要求,根据已有标准对每个校准周期样件的力学性能进行测试,用后一次测得的性能数据与前一次测得的性能数据之间的相对误差表征增材制造性能均一性。
(五) 风险受益分析
1. 风险分析
注册申请人需对增材制造聚醚醚酮植入物的风险进行分析,建议主要包括以下几点:
① “医工”团队的资质是否符合要求;
② 个性化植入物的临床应用范围;
③ 个性化设计带来的不确定性风险;
④ 增材制造工艺方法带来的不确定风险,包括工艺对材料的理化性能的改变、制造设备或工艺不稳定等。
2. 受益分析
注册申请人需对增材制造聚醚醚酮植入物实施的受益进行分析,建议主要包括以下几点:
① 为特殊病损患者提供无可替代的植入物产品;
② 为患者提供适配程度更高,性能不低于现有产品的植入物产品,从而获得更优的临床治疗效果。
(六) 举例
本指导原则给出以下几类典型的增材制造聚醚醚酮植入物为例,对其技术性要求中非共性的部分给出范例作为参考。
1. 增材制造聚醚醚酮个性化胸肋骨替代物
1.1 临床应用范围
增材制造聚醚醚酮个性化胸肋骨替代物用于治疗胸骨肿瘤切除造成的胸肋骨缺损。市场上尚无同类产品可用。
1.2 植入物的设计
1.2.1 植入物结构与病损部位的匹配性
个性化胸肋骨替代物的整体形貌与被切除胸肋骨的原始形貌相同,需能实现肿瘤扩大切除(通常为3cm)后肋骨缺损区域的解剖学重建;植入物与肋骨残端采用内接触方式,由直径1mm的不可吸收金属缝合线环抱式捆绑固定。
个性化胸肋骨替代物的主要功能是支撑和保护脏器,肋骨部分截面形状与人体肋骨相近以起到足够的支撑保护作用,对内避免压迫脏器,对外恢复胸壁外观效果。
1.2.2 植入物的强度
胸肋骨位于人体躯干,不承担支撑人体或运动的功能,使用静力学方法进行安全系数计算,胸肋骨替代物的安全系数不小于1.5。
1.3 生产制造
使用材料挤出增材制造工艺制造聚醚醚酮个性化胸肋骨替代物。所使用的增材制造设备所制备的聚醚醚酮样件的最大弯曲强度需满足设计要求。
2. 增材制造聚醚醚酮个性化颅骨补片
2.1 临床应用范围
使用增材制造聚醚醚酮个性化颅骨补片的颅骨成形术能够治疗大尺寸的颅骨缺损。
2.2 植入物的设计
2.2.1 个性化颅骨补片与病损部位的匹配性
个性化颅骨补片植入患者头部,其外轮廓与缺损部位原始外形相同,具有多个通孔以起到悬吊脑膜和初期引流作用;个性化颅骨补片起到保护颅脑的功能,其厚度不小于3mm,与人体颅骨接近并具有足够的抗冲击能力。颅骨补片与宿主骨的连接方式为螺钉固定、骨连接片或颅骨锁。
2.2.2 个性化颅骨补片的强度
颅骨位于人体头部,不承担支撑人体或运动的功能,使用静力学方法进行安全系数计算,颅骨补片的安全系数不小于1.5。
2.3 生产制造
使用材料挤出增材制造工艺制造聚醚醚酮个性化颅骨补片,所使用的增材制造设备所制备的聚醚醚酮样件的缺口冲击韧性不低于5KJ/m2。
五、参考文献
1. 《医疗器械监督管理条例》(中华人民共和国国务院令第680号)
2. 《医疗器械注册管理办法》(国家食品药品监督管理总局令第4号)
3. 《医疗器械生产质量管理规范》(国家食品药品监督管理总局2014年第64号)
4. 《定制式医疗器械监督管理规定(试行)》(国家药品监督管理局2019年第53号)
5. 《无源植入性骨、关节及口腔硬组织个性化增材制造医疗器械注册技术审查指导原则》(2019年第70号)
6. 《个性化匹配骨植入物及工具医工交互质控审查指导原则》(2020年第62号)
7. 《定制式个性化骨植入物等效性模型注册技术审查指导原则》(2020年第48号)
8. 《骨科金属植入物有限元分析资料注册技术审查指导原则》(2020年第48号)
9. 《医疗器械动物实验研究技术审查指导原则第一部分:决策原则》(2019年第18号)
10. GB/T 12417.1-2008《无源外科植入物骨接合与关节置换植入物第1部分:骨接合植入物特殊要求》
11. GB/T 35351-2017《增材制造术语》
12. GB/T 39329-2020《增材制造测试方法标准测试件精度检验》
13. YY/T 0640-2016《无源外科植入物通用要求》
14. YY/T 0660-2008《外科植入物用聚醚醚酮(PEEK)聚合物的标准规范》
附录1
附录2
增材制造聚醚醚酮各向异性力学性能测试方法
一、 测试项目及方法
需根据聚醚醚酮植入物服役过程中的主要受力方式选取全部或部分适用测试项目进行力学性能各向异性测试。并论证所选取的测试项目的与植入物服役的力学环境的关联性。力学测试项目方法包括但不限于表2列出的性能测试及标准。
表2. 增材制造聚醚醚酮力学性能测试依据的标准
|
测试项目
|
标准
|
|
拉伸
|
GB/T 1040.1
|
|
压缩
|
GB/T 1041
|
|
弯曲
|
GB/T 9341
|
|
扭转
|
GB/T 15047
|
|
短梁剪切
|
GB/T 30969
|
|
层间剪切
|
GB/T 1450.1
|
|
冲击
|
GB/T 1843
|
|
拉-拉疲劳
|
GB/T 35465.1
|
|
磨损
|
ASTM G99
|
二、样件制备
每项力学性能需采用三种不同方式制备的增材制造样件进行各向异性测试,考察增材制造中沿打印路径、相邻打印路径和相邻打印层方向上的力学性能。样件制备原则是使样件的受力方向与打印层和打印路径有如下关系:力方向垂直于打印层平面;力方向与打印层平面共面且垂直于打印路径;受力方向与打印层平面共面且平行于打印路径。
由于后处理工艺可能会影响产品力学性能,所以各项异性测试试样需完成增材制造和后处理(如适用)工艺后进行。具体如下:
(一) 拉伸试样制备
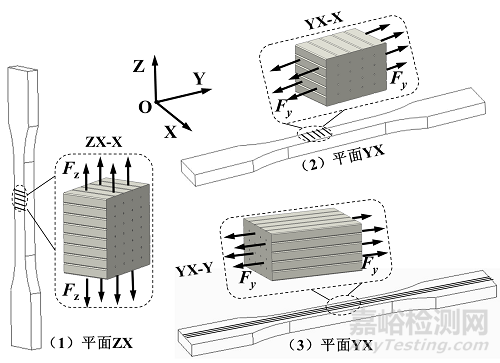
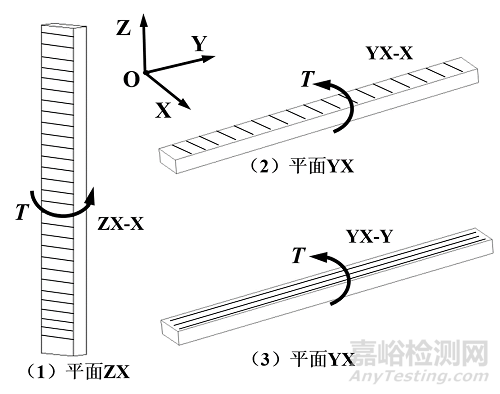
为了准确测试增材制造聚醚醚酮试样的拉伸力学性能及各向异性特征,如附图1所示,制备三种不同方向的试样来评估力学性能,分别为:YX-X、YX-Y和ZX-X。其中,前面两个坐标字符表示试样成形的方向;最后一个坐标字符表示喷头打印路径方向。例如,YX-X,YX代表试样边界框的最长边界和最短边界位于YX平面内(薄型试样厚度方向不计),最后的X字符表示喷头打印路径与X轴平行。根据相关力学性能测试标准规定的样件数量要求制备拉伸试样。
图1. 拉伸试样模型及制备
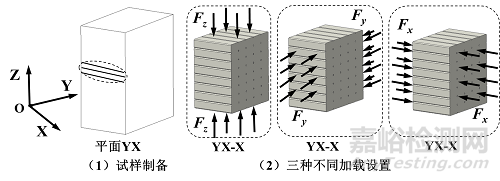
(二) 压缩试样制备
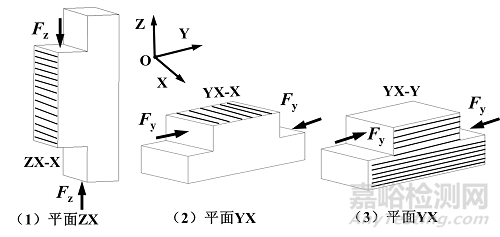
对于压缩试样,采用平面YX作为成形方向,喷头打印路径平行于X轴或Y轴方向。如附图2所示,分别采用沿X轴、Y轴和Z轴的压缩载荷以评估三个方向的力学性能。
图2. 压缩试样模型及制备
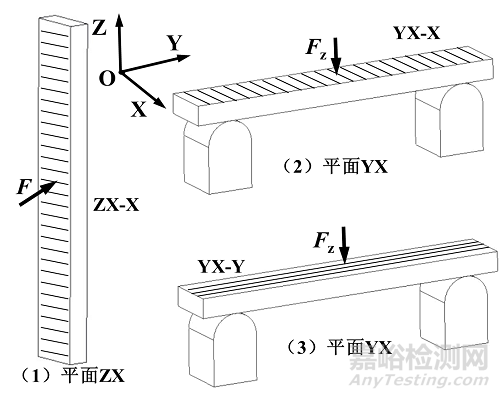
(三) 弯曲试样制备
分别使用YX-X、YX-Y和ZX-X试样测试样件的弯曲性能,如附图3所示。该命名方式与拉伸试样相同。
图3. 弯曲试样模型及制备
(四) 扭转试样制备
分别使用YX-X、YX-Y和ZX-X试样测试样件的扭转性能,如附图4所示。该命名方式与拉伸试样相同。
图4. 扭转试样模型及制备
(五) 剪切试样制备
1. 短梁剪切
对于短梁剪切测试原理与弯曲测试相似,故短梁剪切测试试样的制备与弯曲试样制备相同,分别采用三种方向的测试结果来评估各方向的剪切性能。
2. 层间剪切
分别使用YX-X、YX-Y和ZX-X试样来测试样件的层间剪切性能,如附图5所示。该命名方式与拉伸试样相同。
图5. 层间剪切试样模型及制备
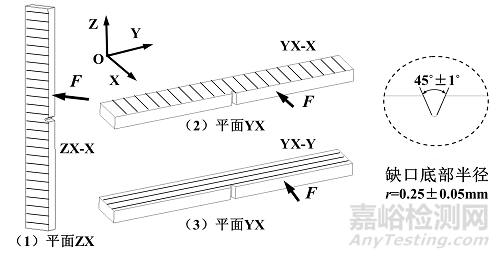
(六) 冲击试样制备
参照标准GB/T 1483,以A型试样为例进行冲击试样制备,分别采用YX-X、YX-Y和ZX-X试样进行冲击性能测试,如附图6所示。该命名方式与拉伸试样相同。制备直长型试样并通过机加工制备缺口,缺口形状和尺寸参见标准GB/T 1483。
图6. 冲击试样模型及制备
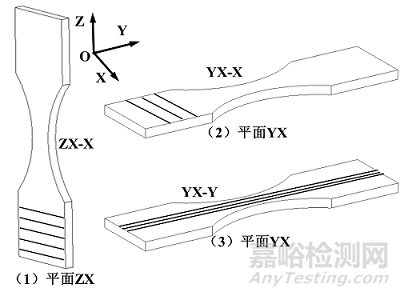
(七) 疲劳试样制备
参照标准GB/T 35465.3,以哑铃型试样为例,分别采用YX-X、YX-Y和ZX-X试样进行拉-拉疲劳性能测试,如附图7所示。该命名方式与拉伸试样相同。
图7. 拉-拉疲劳测试试样模型及制备
三、 结果计算和分析
增材制造聚醚醚酮样件的各向异性如下方式计算:若任一力学性能测试项目所得的三种样件的破坏应力分别为σx、σy、σz,各项异性为σx、σy、σz中最大值与最小值的差与最大值的比值。进一步论证比值的可接受性。