您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2021-04-21 08:50
临床评价、临床试验是上市前最重要的环节之一,也是业界长期关注的焦点问题。新《医疗器械监督管理条例》对医疗器械临床评价相关要求进行了全面修订,部分条款如下:
首次提出“可以免于进行临床评价的情形”
第二十四条提出“医疗器械产品注册、备案,应当进行临床评价,但是符合下列情形之一,可以免于进行临床评价:
工作机理明确、设计定型,生产工艺成熟,已上市的同品种医疗器械临床应用多年且无严重不良事件记录,不改变常规用途的;
其他通过非临床评价能够证明该医疗器械安全、有效的”。
明晰表述“进行医疗器械临床评价的路径”,准确界定“应当开展临床试验的医疗器械”
第二十五条明确“进行医疗器械临床评价,可以根据产品设计特征、临床风险、已有临床数据等情形,通过开展临床试验,或者通过对同品种医疗器械临床文献资料、临床数据进行分析评价,证明医疗器械安全、有效”。
“按照国务院药品监督管理部门的规定,进行医疗器械临床评价时,已有临床文献资料、临床数据不足以确认产品安全、有效的医疗器械,应当开展临床试验”。
因此根据条例首先不要混淆临床评价和临床试验的概念,要清楚二者关系。然后看自己产品是否属于免临床评价的范围,如果不能免除那就要进行临床评价。
临床评价的两种途径是同品种比对和临床试验,再按照自身情况判定,若比对分析不足以证明安全有效那就要开展临床试验。
最后,还要多多关注后续要发布的一系列配套指导原则,对号入座不同阶段,指导我们在开展临床评价及决策是要进行临床试验的过程中不迷路~
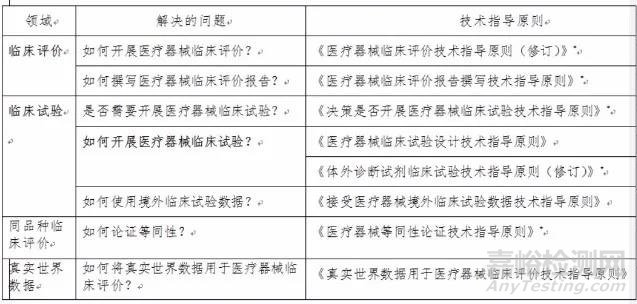
此表来源:国家药监局医疗器械技术审评中心主任孙磊《以保护人民健康、促进创新发展为使命推动医疗器械临床评价改革向纵深化发展》

来源:医疗器械创新网


