您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-04-21 08:25
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
荣昌生物HER2靶向ADC新药即将获批。荣昌生物HER2靶向抗体偶联药物(ADC)维迪西妥单抗(RC48, disitamab vedotin)日前已完成生产现场检查。该公司建立了2000L规模的细胞培养生产线、小分子合成、偶联及ADC制剂罐装生产线,为RC48上市生产做好了充分准备。目前该新药拟用于治疗复发/转移后至少接受过2个系统化疗的HER2过表达局部晚期或转移性胃癌的上市申请正在接受CDE优先审评,预计即将获批上市。
国内药讯
1.石药PI3K双重抑制剂度恩西布申报上市。石药集团宣布,其附属公司中奇制药度恩西布胶囊(克必妥)的上市申请已获CDE受理,并获附条件批准上市及优先审评资格。度恩西布是按照化药5.1类申报的一款PI3K-δ/PI3K-γ双重抑制剂,拟用于治疗至少经过两线治疗的复发/难治性滤泡性淋巴瘤成年患者。在美国,FDA已于2018年9月批准该品种上市,是首个获批的PI3K-δ/PI3K-γ双重抑制剂。石药集团拥有该产品在中国区开发及商业化的独家许可权。
2.生诺医药新型抗酸药物X842启动Ⅲ期临床。生诺医药1类化药X842胶囊(SND001)登记启动一项Ⅲ期临床,评估与兰索拉唑肠溶胶囊相比用于治疗反流性食管炎的有效性和安全性。主要研究者是首都医科大学附属北京友谊医院主任医师张澍田博士,研究计划在中国境内入组352人。X842是Cinclus Pharma开发的一款“best-in-class”钾离子竞争性酸阻滞剂,生诺医药拥有该新药亚洲区域开发、生产及商业化的权益。
3.诺诚健华RTK抑制剂ICP-033新药申报临床。诺诚健华1类创新药ICP-033片临床试验申请获CDE受理。ICP-033是诺诚健华具有全球自主知识产权的一款新型RTK抑制剂,通过作用于DDR1/2、VEGFR 2/3以及PDGFR α/β等受体酪氨酸激酶,可抑制肿瘤血管形成,改善肿瘤微环境,抑制肿瘤生长、侵袭和转移,从而发挥靶点特异性抗肿瘤作用。该新药拟单用或/和免疫疗法及其他靶向药联合治疗肝癌、肾细胞癌、大肠癌及其他实体肿瘤。
4.齐鲁引进一款“first-in-class”ADC新药。齐鲁制药与Peptron公司就Peptron一款临床前期抗癌药PAb001达成一项独家授权协议。PAb001是一款MUC1靶向抗体偶联药物(ADC),已在体外研究中显示出可降低乳腺癌细胞的增殖,并在小鼠模型中能有效靶向乳腺癌中的MUC1。根据协议,齐鲁制药将获得PAb001在全球范围内开发、生产、销售和商业化的独家授权。值得一提的是,最近一年齐鲁至少与四家公司达成授权合作,引进了多款潜在“first-in-class”候选药。
5.恒瑞2020年财报:营收277亿。4月19日,恒瑞医药公布2020年年报,全年营业收入277.35亿元,同比增长19.09%;归属于上市公司股东的净利润63.28亿元,同步增长18.78%;研发费用49.89亿元,同比增长28.04%,占营业收入的比重达到17.99%。产品销售方面,肿瘤药品报告期内销售收入为152.68亿元,较去年增长44.37%,造影剂产品销售额较去年增长12.4%,麻醉产品同比下降16.63%。
国际药讯
1.赛诺菲CD38抗体组合治疗MM在欧盟获批。欧盟委员会(EC)批准赛诺菲(Sanofi)CD38抗体Sarclisa(isatuximab,伊沙妥昔单抗)联合卡非佐米和地塞米松(Kd)用于治疗经治的复发性多发性骨髓瘤(MM)成年患者。去年6月,EC已批准Sarclisa与另一种标准护理方案波马利度胺和地塞米松(pom-dex)联用,用于治疗既往至少接受过两种治疗(包括来那度胺和蛋白酶体抑制剂)进展的复发性难治性MM成人患者。
2.Alnylam皮下注射RNAi疗法达Ⅲ期所有临床终点。Alnylam公司RNAi疗法vutrisiran治疗遗传性转甲状腺素蛋白淀粉样变性的Ⅲ期临床HELIOS-A达到主要终点和所有次要终点。vutrisiran治疗组9个月时患者mNIS+7评分(评估神经病损伤的一种方式)与基线相比平均下降2.24点,而历史安慰剂组平均上升14.76点;Norfolk QoL-DN评分与历史安慰剂组相比改善了16.2点,对患者行走速度等其它生理指标的评估同时也得到改善。目前该新药已向FDA递交了新药申请,如果获批,将成为Alnylam获得FDA批准的第四款RNAi疗法。
3.安进创新胃癌一线疗法获FDA突破性疗法认定。FDA授予安进FGFR2b抗体bemarituzumab突破性疗法认定,与化疗联用一线治疗HER2阴性局部晚期或转移性胃癌和胃食管结合部癌患者。在一项Ⅱ期临床FIGHT中,bemarituzumab与化疗联用显著改善这类患者的无进展生存期和总生存期;而且临床获益与FGFR2b阳性的肿瘤细胞比例有正相关性。再鼎医药拥有该新药在大中华区的开发权益。
4.膀胱癌首创新药Padcev获FDA优先审查资格。FDA受理Seagen/安斯泰来抗体偶联药物(ADC)Padcev(enfortumab vedotin)治疗尿路上皮癌(UC)的2份补充申请(sBLA)并授予了优先审查资格。Padcev已于2019年12月获FDA加速批准上市,用于治疗已接受一种PD-1/L1治疗、并接受过含铂化疗的局部晚期或转移性UC。2份sBLA中,第一份sBLA基于Ⅲ期EV-301试验的数据,旨在将Padcev由加速批准转变为常规批准。第二份sBLA基于关键性EV-201试验队列2的数据,旨在扩大目前的药物标签,纳入曾接受过一种PD-1/L1抑制剂治疗、没有资格接受顺铂治疗的局部晚期或转移性UC患者。
5.广谱新冠中和抗体进入关键性临床。Adagio公司宣布已完成由RA Capital Management领投的3.36亿美元C轮融资,用于支持其“广谱”新冠中和抗体ADG20的临床开发。Adagio已启动了一项ADG20在健康志愿者中进行的Ⅰ期临床,并正在具有高风险的轻中度COVID-19患者中进行关键性的Ⅰ/Ⅱ/Ⅲ期临床。该试验的战略设计旨在使ADG20能够迅速进展到概念验证阶段,如果结果积极,则可支持提交紧急使用授权申请。
6.强生、艾伯维、梯瓦和Endo面临巨额诉讼。据外媒报道,强生、艾伯维旗下艾尔建、梯瓦制药和Endo将面临一场虚拟审判,原因是它们被指控淡化阿片类药物成瘾的风险,以促进这种强效止痛药的销售。加州几个大县和城市政府对这四家公司提起了诉讼,要求获得高达500亿美元的损害赔偿。据悉。美国各地仍有3400多起此类诉讼悬而未决,预计未来几个月将有更多的案件进入审判阶段。
医药热点
1.国家医学中心再添两学科。国家神经疾病医学中心和国家传染病医学中心设置日前完成。据悉,国家神经疾病医学中心是由以复旦大学附属华山医院作为主体设置,以及首都医科大学宣武医院、首都医科大学附属北京天坛医院为联合主体设置的国家神经疾病医学中心共同构成。国家传染病医学中心中是由复旦大学附属华山医院和首都医科大学附属北京地坛医院为依托设置的国家传染病医学中心共同构成。
2.25-59岁新冠确诊和住院患者增速上升。当地时间4月19日,世卫组织在新闻发布会上宣布,上周全球新增新冠肺炎确诊病例超过520万例,是疫情暴发以来单周新增病例数之冠,目前已连续8周上升;新增死亡病例数连续五周上升,目前全球死亡病例已超300万。此外,25-59岁确诊患者和住院患者数量增速惊人,这可能是变异新冠病毒株传播和年轻人进行社交聚集导致。
3.恒瑞独立董事李援朝任期届满辞职。恒瑞医药4月19日发布公告,根据公司有关规定,其现任独立董事李援朝于2015年5月起连任时间将达到六年,任期即将届满,已向公司董事会提请辞去公司独立董事及董事会下属专门委员会相关职务。李援朝辞职后将不再担任公司任何职务。
审评动向
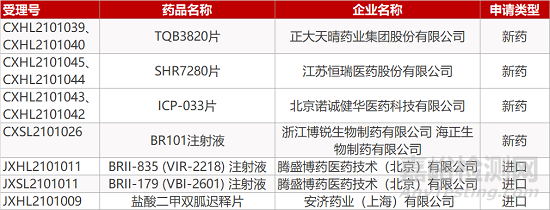
1. CDE新药受理情况(04月17日)
申请临床:
正大天晴的TQB3820片(2个规格)、恒瑞医药的SHR7280片(2个规格)、诺诚健华的ICP-033片(2个规格)、江博锐/海正生物的BR101注射液、安济药业的盐酸二甲双胍迟释片、腾盛博药的BRII-835 (VIR-2218) 注射液和BRII-179 (VBI-2601) 注射液。
申请生产:
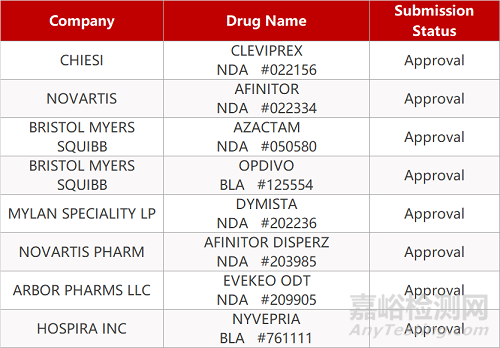
2. FDA新药获批情况(北美04月16日)
股市资讯
【太极集团】控股子公司西南药业股份有限公司的左氧氟沙星氯化钠注射液获得药品注册证。
【北陆药业】碘海醇注射液通过仿制药一致性评价。
【恒瑞医药】(1)硫酸氢伊伐布雷定缓释片获批临床。(2)子公司苏州盛迪亚的SHR-1314注射液获批成人狼疮肾炎适应症临床。

来源:药研发


