您当前的位置:检测资讯 > 行业研究
嘉峪检测网 2021-02-05 23:27
2月5日,国家药监局官网发布《2020年度医疗器械注册工作报告》(以下简称《报告》)。《报告》对2020年国家药监局受理、批准的各类医疗器械的注册申请等数据进行了分析。详情如下。
受理注册申请10579项
《报告》显示,2020年,国家药监局共受理医疗器械首次注册、延续注册和许可事项变更注册申请10579项,与2019年相比增加15.6%。其中,受理境内第三类医疗器械注册申请4220项,受理进口医疗器械注册申请6359项。
按注册品种区分,医疗器械注册申请7102项,体外诊断试剂注册申请3477项。按注册形式区分,首次注册申请2011项,占全部医疗器械注册申请的19%;延续注册申请5886项,占全部医疗器械注册申请的55.6%;许可事项变更注册申请2682项,占全部医疗器械注册申请的25.4%。注册形式比例情况见图1。
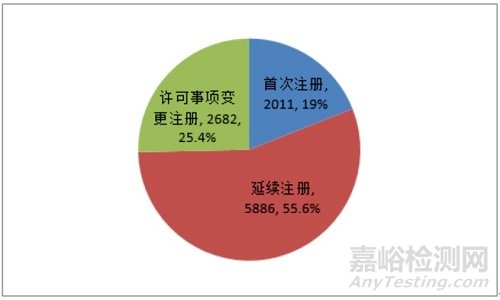
图 1 注册受理项目注册形式比例图
01、境内第三类医疗器械注册受理情况
《报告》显示,2020年,国家药监局共受理境内第三类医疗器械注册申请4220项,与2019年相比增加20.2%;其中,医疗器械注册申请2793项,体外诊断试剂注册申请1427项。
从注册形式看,首次注册1287项,占全部境内第三类医疗器械注册申请数量的30.5%;延续注册2165项,占全部境内第三类医疗器械注册申请数量的51.3%;许可事项变更768项,占全部境内第三类医疗器械注册申请数量的18.2%。注册形式分布情况见图2。
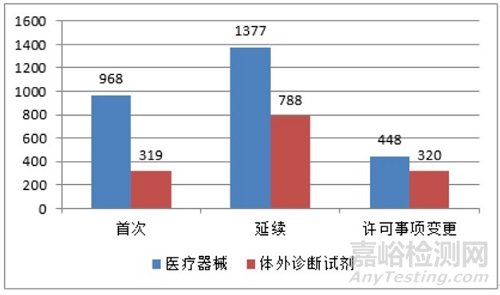
图 2 境内第三类医疗器械注册受理项目注册形式分布图
02、进口第二类医疗器械注册受理情况
《报告》显示,2020年,国家药监局共受理进口第二类医疗器械注册申请3311项,与2019年相比增加8.5%。其中,医疗器械注册申请1738项,体外诊断试剂注册申请1573项。
从注册形式看,首次注册314项,占全部进口第二类医疗器械注册申请数量的9.5%;延续注册2069项,占全部进口第二类医疗器械注册申请数量的62.5%;许可事项变更928项,占全部进口第二类医疗器械注册申请数量的28%。注册形式分布情况见图3。
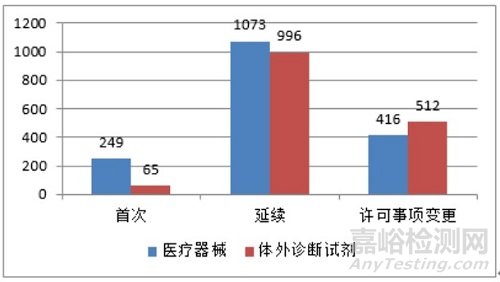
图 3 进口第二类医疗器械注册受理项目注册形式分布图
03、进口第三类医疗器械注册受理情况
《报告》显示,2020年,国家药监局共受理进口第三类医疗器械注册申请3048项,与2019年相比增加20%。其中,医疗器械注册申请2571项,体外诊断试剂注册申请477项。
从注册形式看,首次注册410项,占全部进口第三类医疗器械注册申请数量的13.5%;延续注册1652项,占全部进口第三类医疗器械注册申请数量的54.2%;许可事项变更986项,占全部进口第三类医疗器械注册申请数量的32.3%。注册形式分布情况见图4。
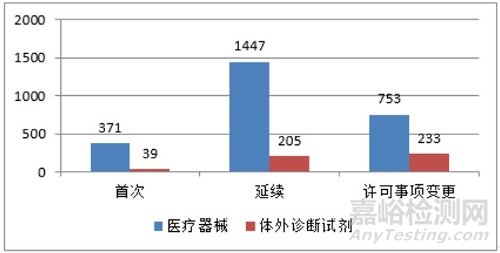
图 4 进口第三类医疗器械注册受理项目注册形式分布图
批准注册申请9849项
《报告》显示,2020年,国家药监局共批准医疗器械首次注册、延续注册和变更注册9849项,与2019年相比注册批准总数量增长16.3%。其中,批准首次注册1572项,与2019年相比减少8.9%;批准延续注册5526项,与2019年相比增加22.7%;批准许可事项变更2751项,与2019年相比增加22.8%。 注册形式比例情况见图5。
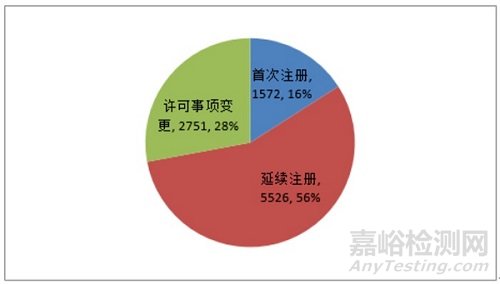
图 5 注册形式比例图
01、境内第三类医疗器械注册审批情况
2020年,国家药监局共批准境内第三类医疗器械注册3603项。其中,医疗器械2306项,体外诊断试剂1297项。
从注册形式看,首次注册1020项,占全部境内第三类医疗器械注册数量的28.3%,延续注册1823项,占全部境内第三类医疗器械注册数量的50.6%;许可事项变更注册760项,占全部境内第三类医疗器械注册数量的21.1%。注册形式分布情况见图6。
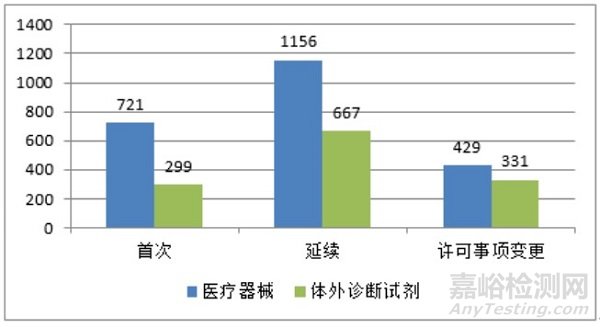
图 6 境内第三类医疗器械注册形式分布图
02、进口第二类医疗器械注册审批情况
2020年,国家药监局共批准进口第二类医疗器械注册3437项。其中,医疗器械注册1639项,体外诊断试剂注册1798项。
从注册形式看,首次注册307项,占全部进口第二类医疗器械注册数量的8.9%;延续注册2153项,占全部进口第二类医疗器械注册数量的62.6%;许可事项变更注册977项,占全部进口第二类医疗器械注册数量的28.5%。注册形式分布情况见图7。
图片图 7 进口第二类医疗器械注册形式分布图
03、进口第三类医疗器械注册审批情况
2020年,国家药监局共批准进口第三类医疗器械注册2809项。其中,医疗器械注册2351项,体外诊断试剂注册458项。
从注册形式看,首次注册245项,占全部进口第三类医疗器械注册数量的8.7%;延续注册1550项,占全部进口第三类医疗器械注册数量的55.2%;许可事项变更注册1014项,占全部进口第三类医疗器械注册数量的36.1%。注册形式分布情况见图8。
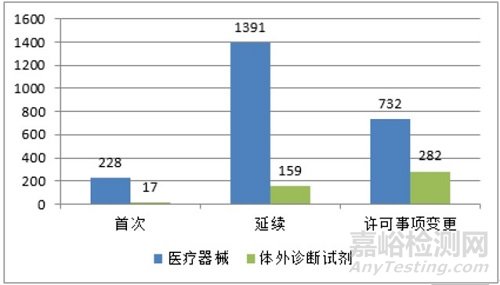
图 8 进口第三类医疗器械注册形式分布图
批准品种种类分析
根据《报告》中的数据,注册的境内第三类医疗器械,除体外诊断试剂外,共涉及《医疗器械分类目录》中18个子目录的产品。注册数量前五位的境内第三类医疗器械是:无源植入器械、注输、护理和防护器械、神经和心血管手术器械、医用成像器械和有源手术器械,与2019年相同。其中医用成像器械从2019年的67项,增加到2020年的80项,增加约20%。
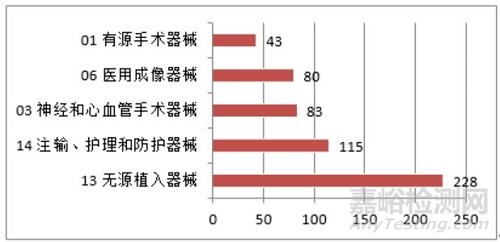
图 9 境内第三类医疗器械注册品种排位图
注册的进口医疗器械,除体外诊断试剂外,共涉及《医疗器械分类目录》中21个子目录的产品。注册数量前五位的进口医疗器械,主要是:口腔科器械、医用成像器械、无源植入器械、神经和心血管手术器械、眼科器械。其中,口腔科器械从2019年的57项,增加到2020年的66项,增加约15.8%。眼科器械取代临床检验器械,进入前五位。
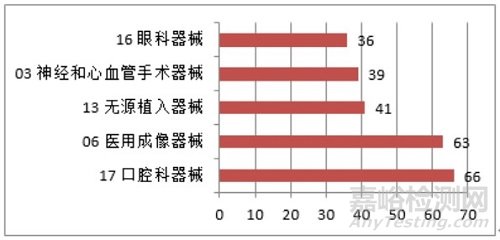
图10 进口医疗器械注册品种排位图
进口医疗器械的国别情况
2020年,共有26个国家(地区)产品在我国获批上市,其中,美国、德国、日本、韩国、瑞士医疗器械在中国医疗器械进口产品首次注册数量排前5位,注册产品数量约占2020年进口产品首次注册总数量的72.3%,与2019年相比略有下降。
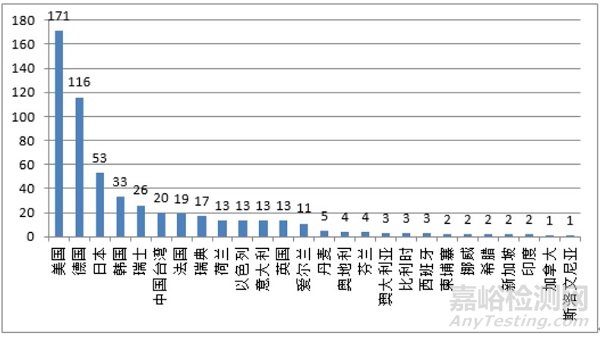
图 11 进口医疗器械国别排位图
从进口医疗器械代理人分布看,共有17个省涉及有本省企业作为进口医疗器械代理人,其中上海市代理人代理的进口首次医疗器械数量最多,占全部进口医疗器械数量的64.9%。
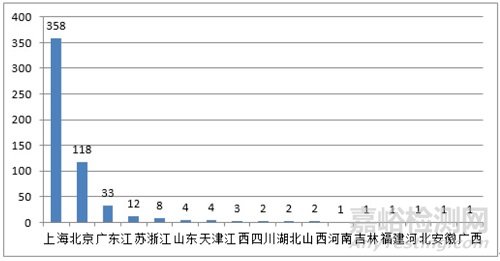
图 12 代理人代理的进口医疗器械数量省份排位图

来源:国家药监局官网


