您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-02-03 22:39
生理药动学模型( physiologically based pharmacokinetic models,PBPK模型)是根据机体的生理、生化及解剖学知识,用每一房室代表一种器官或组织,模拟机体循环系统的血液流向,将房室相互联结,建立的由实际血流速率、组织/血液分配系数及化合物性质控制药物遵循物质平衡原理在机体内进行转运的数学模型[1]。利用PBPK模型可通过整合人体的生理参数、药物理化性质和药动学数据,预测药物在人体内的药动学特性。
2012年3月,美国食品药品监督管局(FDA) 由表决支持PBPK方法用于儿科临床试验设计[2];2013年FDA临床药理办公室新成立了PBPK小组,专门审阅新药申请研究中的PBPK分析报告;截至2016年8月,共有217个利用PBPK申请豁免部分临床试验及指导患者临床用药的案例在FDA被审阅[3]。为规范以注册为目的的PBPK研究,FDA和欧洲药品管理局(EMA) 均于2016年出台了PBPK研究指南[4-5]。
目前,利用PBPK模型,在药物发现阶段,通过对药物药动学性质的预测,有助于候选药物的筛选;在临床前阶段,利用体外数据结合生理放大系数,可预测候选药物在动物和人体的药动学行为,结合体外代谢实验,可预测药物-药物的相互作用;在临床阶段,有助于预测药物在不同人群(不同年龄、不同疾病状态、不同种族)的药动学差异[6]。国内BPPK模型在新药研发及监管领域中的应用,近年来也已经引起国家药品监督管理局药品审评中心(CDE) 的关注[7-8]。
固体口服制剂在体内首先必须在胃肠液中溶出才能被吸收并到达体循环,药物在体内的释放和吸收过程直接影响其药效。溶出度试验作为模拟固体口服制剂在胃肠道中崩解和溶出的理想体外试验法,是评价和控制药品固体口服制剂质量的重要指标。理想的溶出度测定通过选择合理的溶出装置和溶出介质,模拟药物在胃肠道环境中的崩解与释放过程。如果两种固体口服制剂在模拟条件下具有相同的溶出曲线,预示它们在体内具有相似的崩解与溶出过程,因而在胃肠黏膜表面具有相同的药物浓度-时间曲线,并具有相同的吸收速度和程度,实现生物等效[9]。
目前溶出度实验被赋予了处方优化、制备工艺评价、保证产品质量持续一致性等功能。虽然精准模拟药物在胃肠道环境中崩解与溶出过程的生理相关溶出度测定方法(biorelevant in vitro dissolution method)已经取得了较大的进展[10],但在药品仿制时,采用经典的溶出度测定方法,比较仿制药与参比制剂在不同溶出介质中溶出曲线的相似性,仍然是药品审评机构的推荐办法。
美国FDA药品审评中心仿制药办公室的官方网站上收载有“固体制剂溶出曲线数据库”[11];国家药品审评中心的网站上收载有经编译的“日本厚生省药品体外溶出试验信息库”[12]。然而,由于经典的溶出度测定方法无法精准模拟药物通过成分复杂的不同体液的过程,仅能有限地反映药物在体内的动态溶出过程,当仿制药与参比制剂的溶出曲线不一致时,很难准确判断这种差异对体内生物等效性的实际影响[13-14]。
目前基于药物生物药剂学分类系统(biopharmaceutical classification system,BSC),在仿制药研发中采用体外研究代替体内生物利用度实验,对速释普通固体口服制剂给予生物等效豁免(Biowaiver)的理念已经被逐渐接受[15-16],我国在仿制药一致性评价中也已经发布了关于豁免人体生物等效性(BE)试验的指导原则。国内伴随着仿制药一致性评价的推进,合理评价体外溶出曲线差异对生物等效性的影响变的更为迫切。
在重大新药创制专项课题“化药制剂质量评价关键技术研究(No.2015ZX09303001-001)的支持下,中国食品药品检定研究院、山东省食品药品检验研究院、湖北食品药品监督检验研究院、浙江省食品药品检验研究院和四川省食品药品检验检测院等开展协作研究,利用Gastro PlusTM软件,开展建立PBPK模型,模拟/预测药物体内PK过程的研究,在此基础上探讨评价药物溶出度差异对生物等效性的影响等[17-27]。本文通过对其中典型案例的介绍,阐述建立PBPK模型的原理及用途,以推进一致性评价过程中更好地依据体外溶出曲线预测其体内的生物等效性。
1 、利用Gastro Plus软件建立药物吸收模型及其应用
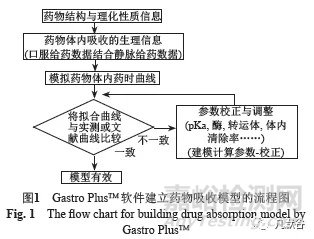
在固体口服制剂的一致性评价中,深入理解药物制剂在体内的吸收特性具有重要意义。建立药物的吸收模型首先应对其吸收过程有较清晰的认知,进而采用传统的房室模型描述药物在体内的分布与消除过程。采用人体口服给药的PK数据结合静脉给药数据建模是建立PBPK吸收模型的最理想方法[28]。图1示Gastro PlusTM 软件建立药物吸收模型的基本步骤,下面将结合实际案例对其进行详细介绍。
1.1 阿莫西林胶囊体内吸收模型及其应用
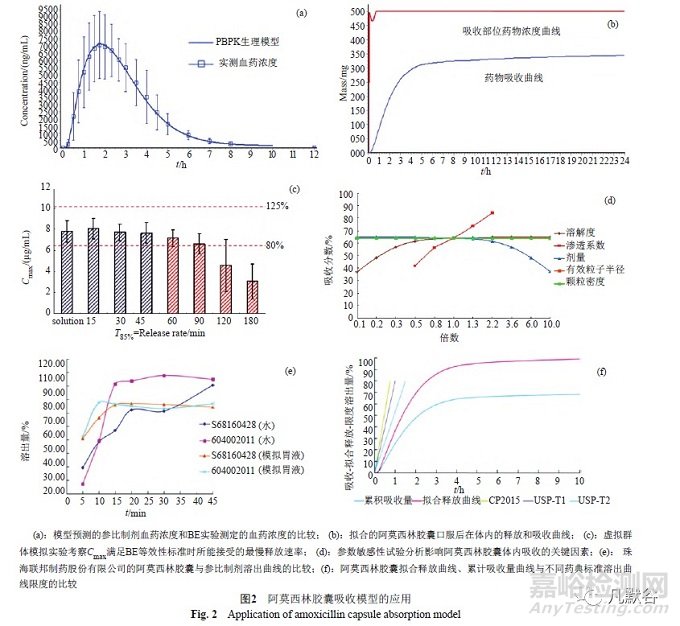
利用Gastro PlusTM 软件建立阿莫西林胶囊体内吸收模型,首先应系统收集文献中的阿莫西林钠、阿莫西林胶囊药动学(PK)及生物等效性(BE)实验的相关数据,确定建模所需要的诸参数(表1);利用表中的理化参数结合人体胃肠道参数分别构建阿莫西林静脉给药和口服给药PBPK模型;利用静脉给药模型得出的PK参数对阿莫西林胶囊PBPK模型进行修正,最终得到口服吸收模型。再通过比较模型拟合的药时曲线及预测的PK参数与文献报道的实际药时曲线及PK参数的差异,评价模型的准确性[17]。实验结果显示,模型预测结果与文献结果非常相似;多篇文献中阿莫西林胶囊的Cmax和AUC值均分布在模型预测值[Cmax和AUC分别为7.62μg/mL和23.68μg/(h·mL)]的80%~125%范围内,说明模型的准确性较好[17]。利用该模型预测某企业用于BE实验的阿莫西林胶囊的人体餐前血药浓度,并与实际BE实验数据进行比较(图2a),模型预测的结果与BE报告吻合(F%=68.7,Cmax=7.12μg/mL,Tmax=1.8h,AUC0→inf =25.55μg/(h·mL),AUC0→t=24.47μg/(h·mL),CmaxLiver=11.01μg/mL),参比制剂和仿制制剂实测结果的R2分别为0.992和0.997[18]。说明该模型可以较准确的预测具体企业阿莫西林胶囊的PK参数,进而对其BE结果进行预测。
通过模型计算阿莫西林胶囊口服后在体内的释放和吸收曲线(图2b)[17],可见,在吸收部位(空肠),阿莫西林的量远高于其被吸收的量;提示当阿莫西林胶囊在胃肠道中表现出不同的释放速率,但在到达吸收部位前完全溶出时,这种释放速率的差异不会引起BE的不等效;进而提示当阿莫西林胶囊在体外溶出实验中表现出与参比制剂不完全相同的溶出特性时,也不一定会导致BE不等效。
采用软件中的群体模拟(population simulation)模型,可以进一步分析药物体内释放速率不同时对Cmax和AUC的影响,当仿制品的Cmax和AUC均值与其90%的置信区间均落入参比制剂Cmax和AUC均值的80%~125%范围内时,可认为二者BE等效性[29]。以阿莫西林胶囊在T85%=15min时药时曲线的平均Cmax和AUC作为参比,通过虚拟群体模拟实验,预测阿莫西林胶囊释放速率不同时的Cmax和AUC,考察满足BE等效性标准时所能接受的最慢释放速率。结果显示,无论是以Cmax还是AUC为指标,阿莫西林胶囊的释放速率为T85%=45min时,仍与参比药物具有生物等效性(图2c)[17],此时,阿莫西林胶囊与口服溶液BE等效,胶囊释放速率的差异可以被忽略。通过参数敏感性试验(PSA)考察阿莫西林的溶解度、剂量、有效粒子半径和颗粒密度在±10倍变化,渗透系数在±2倍变化时药物的吸收情况。可以看出,影响阿莫西林胶囊体内吸收的关键因素是渗透性(图2d),由于阿莫西林是寡肽转运蛋白PEPT1的良好的底物,该蛋白对β-内酰胺抗生素的吸收起着重要的作用[29],因此制剂处方中是否存在PEPT1蛋白的促进剂/抑制剂是影响阿莫西林体内吸收的关键因素。
1.1.1 利用阿莫西林胶囊吸收模型预测不同制剂处方的生物等效性
珠海联邦制药股份有限公司的阿莫西林胶囊处方与参比制剂不同,二者在模拟胃液中虽然溶出行为相似,但当以水为溶出介质时,参比制剂(S68160428)的溶出速率略慢(图2e)(未发表资料)。假定二者在胃肠道中的释放特征与此相似,(1)由于45min时二者的溶出量均大于85%,提示这种差异可能不会影响制剂的生物利用度;(2)将两种典型制剂以水为溶出介质得到的溶出曲线作为体内药物释放曲线加载到软件中,利用模型进行单次模拟(single simulation)和群体模拟实验,均得出二者BE等效的结果;(3)对其处方进行分析,二者处方中均不含寡肽转运蛋白PEPT1的促进剂/抑制剂;因此,认为二者体外溶出行为的差异不会导致其体内吸收的不同。BE实验证实二者等效,使得珠海联邦制药股份有限公司成为首家通过阿莫西林胶囊一致性评价的企业。
1.1.2 利用阿莫西林胶囊吸收模型对体外溶出度方法进行评价[18]
石药集团中诺药业(石家庄)有限公司(石药)在进行阿莫西林胶囊一致性评价时,为实现与参比制剂在体外的溶出特性一致,对原处方进行了改动。BE实验虽然证明仿制品与参比制剂等效,但处方的改动导致制剂的溶出速率变慢,产品不符合中国药典阿莫西林胶囊溶出度检查法之规定。由于参比制剂符合USP溶出度检出法的规定,国产仿制药能否不按照中国药典标准进行质量控制?利用建立的PBPK模型,计算阿莫西林胶囊在人体的释放过程(释放曲线),并与体外溶出曲线进行比较,评价药典溶出度测定方法是否为体内外相关的溶出方法。通过去卷积分算法拟合阿莫西林胶囊在体内的释放曲线(满足体内累计吸收量的最低药物释放曲线),并与药典溶出度方法得到的溶出曲线限度进行比较(图2f),在不同溶出度方法得到的溶出曲线中,制剂阿莫西林的溶出量均大于其体内最低释放量的要求,说明各国药典的溶出度测定方法均不是体内外相关(IVIVC)方法,其限度仅是为降低产品质量波动风险而设定的标准。因此,实际应用中可根据不同制剂处方的特点,选择适宜的方法与限度控制产品质量。目前国内不同处方的阿莫西林胶囊均已按处方的特点,选择溶出度检查法进行质量控制。
1.2 对盐酸曲美他嗪片生物等效性的评价
盐酸曲美他嗪属于高溶解性药物,但其渗透性不明确。该品种原研企业为法国施维雅公司,在日本橙皮书中有收载。2017年湖北省食品药品检验研究院选用原研产品作为参比制剂,通过建立其PBPK模型评价盐酸曲美他嗪体内释放特征对PK参数的影响,对10家国产企业的片剂与参比制剂的生物等效性进行了评价[19]。其评价方案可概况为:①采用Caco-2单层细胞模型测定药物的渗透性,获得其表观渗透系数Papp;②将实测Papp转化为Peff,建立PBPK模型,探讨体内释放曲线与体内药动学曲线之间的相关性;③比较国产与原研盐酸曲美他嗪片在不同pH条件下体外溶出行为的差异,预测BE等效性。
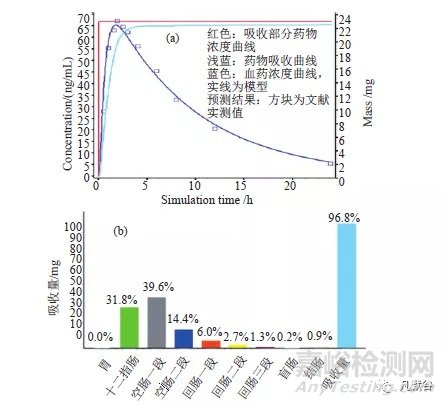
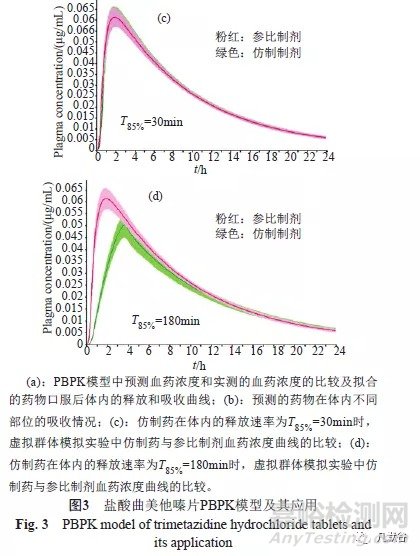
由盐酸曲美他嗪片PBPK模型可知,盐酸曲美他嗪片在体内具有快速释放、极易被吸收之特性(图3a);其主要吸收部分为十二指肠和空肠(图3b);随着体内释放速率的变慢,Tmax、Cmax和AUC均逐渐减小(图3c~d),但当释放速率为T85%=120min时,其均值的90%置信区间仍在参比均值80%~125%范围内,即仍可与原研制剂等效;提示盐酸曲美他嗪片的体外溶出特性不是影响其生物等效的关键因素。
利用所建立的PBPK模型,将参比盐酸曲美他嗪片不同溶出介质中的溶出曲线带入模型,发现以pH6.8缓冲液得到的溶出曲线作为药物体内的释放曲线,预测的PK参数与实测值相关性最好;即溶出度实验中采用pH6.8缓冲液作为溶出介质,比较国产制剂与参比制剂溶出曲线的差异,可得到较理想的IVIVC结果。
1.3 对甲磺酸多沙唑嗪缓释片体外溶出方法的评价
甲磺酸多沙唑嗪(doxazosin mesyllate,DOX)是α1肾上腺素受体阻滞剂,为BCSⅠ类药物。浙江省食品药品检验研究院对甲磺酸多沙唑嗪缓释片的溶出度方法进行体内外相关性评价,为建立合理的体外溶出方法提供依据[20]。其评价方案可概况为:
①查阅甲磺酸多沙唑嗪的理化参数及体内PK数Mass /mg中国抗生素杂志据,通过 GastroPlusTM 构建体内PBPK模型;②将体外溶出数据导入基础模型中,作为体内释放曲线模拟体内的药时曲线,与人体试验实测值进行相关性比较。
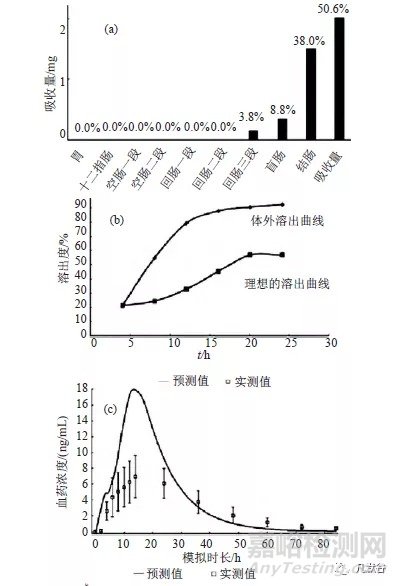
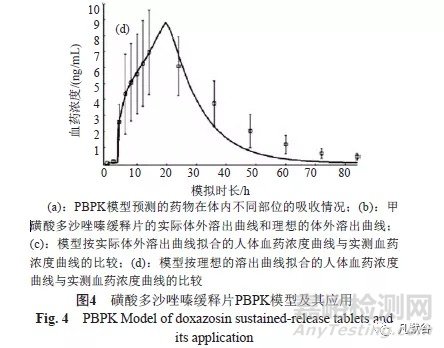
由甲磺酸多沙唑嗪缓释片PBPK模型可知,药物主要在远端肠段吸收(图4a);而甲磺酸多沙唑嗪缓释片按质控标准中的溶出度方法检查时,药物在前12h的溶出速率相对较快,之后溶出速率趋缓,逐渐达到平台期(图4b);将此溶出曲线导入模型,预测给药84h内的药时曲线,可见与文献报道的人体试验实测值明显不同,说明该体外溶出方法无法反映药物体内的实际释放状况(图4c);采用Weibull方程拟合多沙唑嗪在人体的理论释放曲线,以此作为理想的溶出曲线(图4b),以此为基础设计体外溶出度方法,则可以得到理想的IVIVC溶出方法(图4d)。
1.4 对琥乙红霉素片生物等效性的预测
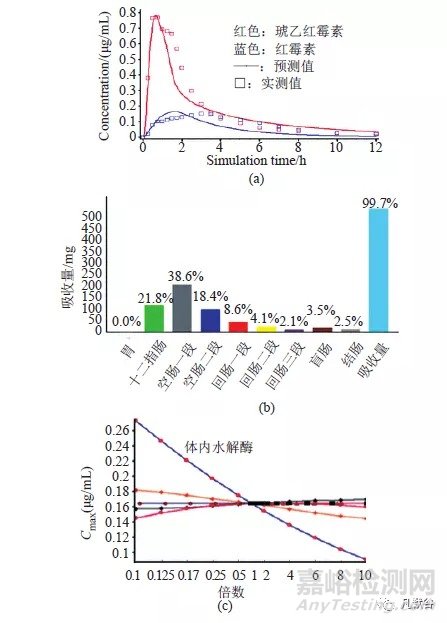
琥乙红霉素为红霉素的乙酰琥珀酸酯,是酯型前药。目前琥乙红霉素颗粒和片剂等在国内外仍被广泛使用,但由于该产品上市时间较早,国内外药品处方、规格等并不完全相同。琥乙红霉素在肠道可被酯酶部分水解,红霉素和酯化物在肠道中可同时被吸收,在体内酯化物被水解成红霉素发挥抗菌作用。早期文献中测定琥乙红霉素的PK参数通常采用微生物检定法,即将血液样本中的琥乙红霉素转化成红霉素后,测定样本中的红霉素总量,因此,无法利用早期的文献数据建立PBPK模型。我们设计了以下评价方案(未发表资料):①意义利用比格犬测定琥乙红霉素的血药浓度,进行生物等效性评价;②建立比格犬PBPK模型,利用外推法建立人体PBPK模型;③利用人体PBPK模型分析琥乙红霉素制剂的药代特点及关键影响因素,预测国内制剂与参比制剂的BE等效性。
首先采用LC-MS分析仿制制剂与参比制剂在比格犬体内的血药浓度,进行生物等效性分析。参比制剂组与仿制药品组的达峰时间(Tmax)、达峰浓度(Cmax)、药时曲线面积(AUC)、表观分布体积(Vz_F)和清除率(CL)均无显著性差异(P>0.05);以红霉素为指标,供试品(琥乙红霉素片)与参比制剂二者具有生物等效性。利用该数据,建立比格犬PBPK模型,并根据软件中的经验公式:CL human (mL/min)=CLanimal[Whuman÷Wanimal]b
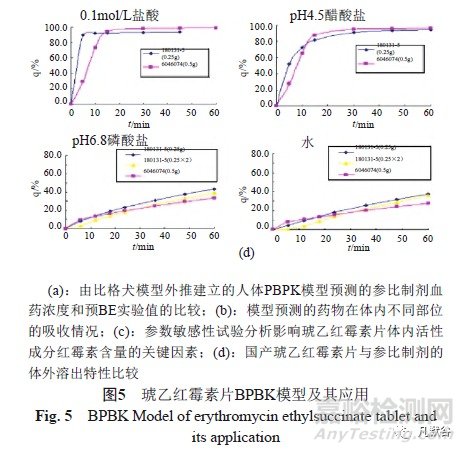
式中,CL:清除率,b:异速放大系数,为0.67;将比格犬模型外推,建立人体PBPK模型(图5a)。红霉素在血液中的浓度主要与肠道水解酶(芳基乙酰胺脱乙酰酶:AADAC)和体内水解酶(肝微粒体细胞色素:CYP-3A4)的作用有关;琥乙红霉素口服后被快速在十二指肠和空肠被吸收(图5b);利用参数敏感性分析,考察琥乙红霉素制剂的溶解度、剂量、代谢酶等参数在±10倍变化以及渗透系数在±2倍变化时,对血药浓度的影响,结果显示,肝脏水解酶是影响琥乙红霉素在体内红霉素浓度的最关键因素(图5c);由于肠道水解酶主要位于空肠,少部分于结肠,不同个体水解酶的差异对体内琥乙红霉素以及红霉素的血药浓度影响显著,提示在进行BE评价时,琥乙红霉素口服制剂呈高变异特征;该结论在后续的正式BE实验中已经被证实(未发表资料)。
分别选取0.1mol/L盐酸、pH4.5醋酸盐、pH6.8磷酸盐和水作为溶出介质,比较国产制剂与参比制剂的体外溶出情况,二者体外溶出特性基本相似(图5d);在酸性条件下:国产制剂的溶出略快,但二者均呈快速溶出(T≤15min,Q>85%)特性;在偏碱性条件下,二者均溶出较慢(300min内Q<40%)。采用Gastro PlusTM 软件,以Z-factor为溶出模型(假设药物瞬间溶出,只受溶解度限制),考察体外溶出曲线对体内药动学行为的影响,结果提示,虽然国产制剂在酸性条件下较参比制剂的溶出更快,但对体内的药代参数几乎没有影响。综上,可以推测国产琥乙红霉素片与参比制剂在人体中BE等效。该结论在后续的正式BE实验被证实(未发表资料)。
2 、利用渗透性分析技术预测制剂的生物等效性
虽然溶出曲线是体外评价药物体内生物等效性的重要手段,但当利用PBPK模型通过敏感性分析证明渗透性是影响药物吸收的重要因素时,评价药物处方对其渗透性的影响成为预测体内BE的关键。目前较成熟的评价药物渗透性的方法是基于人工膜原理[30],采用μFLUXTM 药物渗透性测定仪对仿制制剂与参比制剂的渗透性进行比较[21-22]。该装置(图6a)分为供体室和受体室,中间由人工仿生渗透膜隔开;供体室模拟人体肠液环境,可选择模拟肠液或适宜的缓冲液;受体室模拟血液环境,可选择血浆或适宜的缓冲液;通过光纤实时检测供体室和受体室内药物浓度的变化,计算单位时间内通过单位膜面积的药物量-药物的吸收量(μflux),以此表征药物的吸收特性。如采用Macro FluxTM 装置(图6b),可以同时对药物制剂的溶出行为与渗透速率进行考察[22,31]。
药物的吸收量(μflux)=渗透速率(斜率)×溶液体积/膜表面积
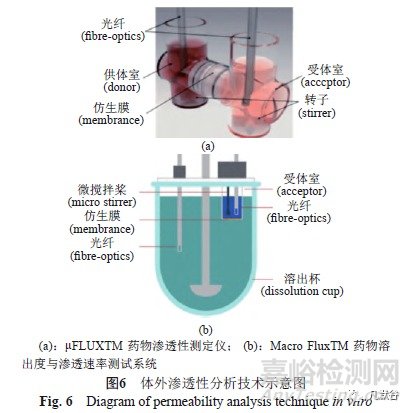
2.1 来氟米特片的生物等效性评价
来氟米特为低溶解性、高渗透性药物,基于药物的体内处置生物药剂学分类系统(BDDCS) 属于Ⅱ类(药物的溶解度较低,药物的溶出是吸收的限速步骤),该品种在日本橙皮书未被收载,赛诺菲的产品在FDA数据库中被认定为参比制剂;2016年山东省食品药品检验研究院结合国家评价性抽验对国产制剂与参比制剂的生物等效性进行了评价[21]。其评价方案可概况为:①分析国产制剂与参比制剂溶出行为的差异;②分析影响药物药动学参数的关键药学特性;③通过对来氟米特片溶解度与渗透性的比较,分析国产制剂与参比制剂关键药学特性的差异,预测二者BE的等效性。
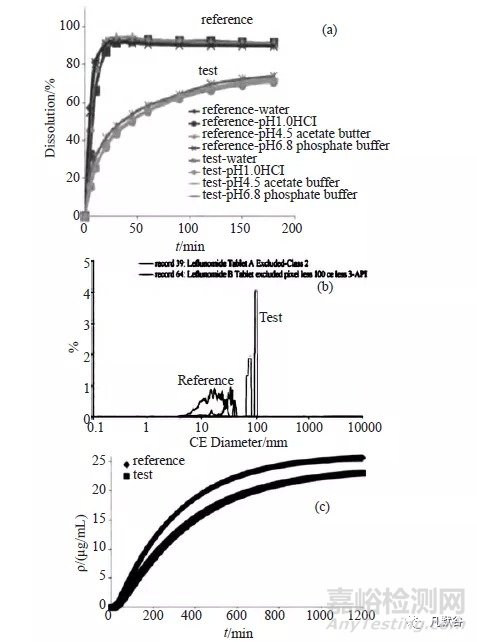
溶出曲线分析表明,国产制剂与参比制剂的溶出曲线明显不同(图7a);针对溶出曲线的差异,采用GastroPlusTM 软件模拟分析API 的溶解度、粒径、渗透性、扩散系数对药动学参数Tmax、Cmax、AUC0→t的影响,认为API的粒径越大、溶解度越低,Tmax越大、Cmax越小、AUC0-t越低。
取来氟米特片崩解液混合均匀的颗粒悬液,滴于石英载玻片上,对其进行颗粒计数、成像和形态观测:参比制剂的Dv 50为17.60μm,多数API颗粒粒径散布在10~30μm,最大粒径不超过40μm; 国产制剂Dv 50为79.8μm; 多数颗粒粒径散布在70~100μm,且存在大于100μm的大粒子;国产制剂的API 颗粒粒径分布明显大于参比制剂(图7b)。
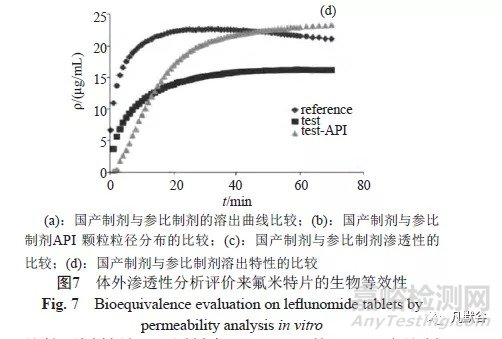
对二者的渗透性进行比较,由于来氟米特为非pH值依赖型药物,吸收不受高脂肪饮食影响,故采用pH6.5的未添加牛胆磺酸钠与卵磷脂的模拟人餐前小肠内肠液(FaSSIF) 溶液作为供体室的溶解介质,受体室选择人血浆;在供给室内投入来氟米特,检测渗透至接受室的来氟米特含量。24h内2种制剂的Tmax基本一致,国产制剂ρmax与AUC0→t均低于参比制剂,ρmax与AUC0→t约为参比制剂的90%(图7c);进一步比较2种制剂与API原料在40~120min的μflux:参比制剂为0.93μg·cm2/min,国产制剂为0.65μg·cm2/min,国产原料为0.95μg·cm2/min,提示国产制剂处方抑制了药物的渗透速率。
对二者供体室中的溶出特性进行比较, 在0~60min,参比制剂的溶出速度较国产制剂快;在最初的15min,国产制剂API的溶出行为与参比制剂相似,但随后的溶解速度与程度均低于原料(图7d),说明国产制剂渗透速率较慢与其处方不能有效地提高API的溶出速率有关。由于生物等效要求受试制剂和参比制剂的主要药动学参数为80%~125%,虽然国产制剂的生物利用度低于参比制剂,但初步推测二者仍可能等效。
3、 结论
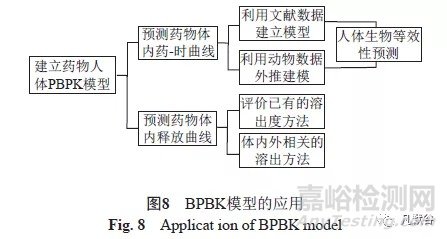
对上述案例进行总结(图8)。可见,在建立人体PBPK模型时,既可以利用已有的人体文献数据,也可以利用动物数据外推建模;利用模型拟合药物体内的药时曲线,可以预测体内药物释放速率的变化对血药浓度的影响,进而预测体外药物溶出曲线的变化对其PK参数的影响。该方法对溶解性不是影响药物吸收的关键因素如BCS III类等药物的评价,忽略制剂处方对药物吸收的影响时,通常可取得较理想结果。当需要评价药物处方对其渗透性的影响时,采用μFLUXTM 药物渗透性测定仪分析制剂中可能影响药物渗透性的关键药学特性,发现仿制药与参比制剂的差异,进而针对性的进行处方优化是较理想的方案。
利用BPBK模型,通过去卷积分算法还可以拟合药物在体内的释放曲线(满足体内累计吸收量的最低药物释放曲线),据此,既可以对现有的溶出度方法进行评价,也可以以此为基础建立生理相关溶出度测定方法。

来源:中国抗生素杂志 2021.01


