您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-09-25 10:36
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
法维拉韦COVID-19日本III期研究成功。富士胶片集团宣布其广谱抗流感病毒药物法维拉韦(Avigan)治疗非重症COVID-19患者的III期临床到达主要终点。该研究今年3月在日本启动,主要终点为RT-PCR检测的SARS-CoV2病毒RNA转阴时间以及症状(体温、血氧饱和度和胸部影像)缓解时间。结果显示,法维拉韦治疗组的中位缓解时间为11.9天,安慰剂组为14.7天,具统计学意义(p=0.0136),调整后的HR为1.593 (95%CI 1.024–2.479)。没有新的安全信号。
国内药讯
1.倍特药业富马酸丙酚替诺福韦片即将获批。成都倍特药业4类仿制药富马酸丙酚替诺福韦片进入行政审批阶段,即将获批上市,有望成为该品种首仿。丙酚替诺福韦(磷丙替诺福韦/替诺福韦艾拉酚胺)是由吉利德研发的一种新型核苷类逆转录酶抑制剂,用于治疗慢性乙型肝炎,2019年全球销售额为4.88亿美元。目前国内市场仅原研产品在售,2019年中国公立医疗机构终端销售额超过3000万元。
2.科伦「中长链脂肪乳/氨基酸(16)/葡萄糖(30%)注射液」首仿报上市。科伦药业3类仿制药「中长链脂肪乳/氨基酸(16)/葡萄糖(30%)注射液」上市申请获CDE受理,为该肠外营养三腔袋产品的国内首家申报上市产品。中长链脂肪乳/氨基酸(16)/葡萄糖(30%)注射液是一种「全合一」营养液输注方式,为国内外指南推荐的肠外营养输注模式,用于需要肠外营养支持的患者,如不能通过食管摄取食物或摄取不足的患者。
3.恒瑞PD-1一线治疗NSCLC Ⅲ期结果积极。恒瑞医药在CSCO2020年会上分享了《艾瑞卡在NSCLC一线治疗中的地位和研究探索》的报告。艾瑞卡(卡瑞利珠单抗)是一款人源化抗PD-1抗体,卡瑞利珠单抗联合化疗一线治疗EGFR/ALK野生型晚期非鳞状非小细胞肺癌(NSCLC)的Ⅲ期临床CameL研究中,ORR高达60%,mDoR达17.6个月,mPFS达11.3个月,相当于EGFR突变患者一线使用一代TKI,ALK阳性患者一线使用克唑替尼的疗效,使更多患者获得长期生存的希望。
4.复宏汉霖地舒单抗HLX-14启动临床。复宏汉霖登记启动一项地舒单抗生物类似药HLX14的I期临床,适应症为高危骨折风险的女性绝经后骨质疏松症。本次临床拟入组432人,试验对照药为安进的地舒单抗注射液(Denosumab,商品名:Prolia)。目前,国内地舒单抗生物类似药尚无获批上市。根据Insight数据库,国内目前已有9个地舒单抗生物类似药启动临床,其中进度最快的已处于III期临床,包括康宁杰瑞、上海迈威、山东博安和齐鲁制药。
5.礼来可逆性BTK抑制剂首次在华申报临床。礼来1类新药LOXO-305的临床试验申请获得CDE受理。LOXO-305是由Loxo Oncology开发的一款高度特异性、非共价BTK抑制剂,礼来于2019年收购Loxo Oncology公司囊获了包括LOXO-305在内的一系列新药。本次是该药首次在中国申报临床。目前,LOXO-305正在全球范围内开展Ⅰ/Ⅱ期临床,LOXO-305用于治疗慢性淋巴细胞白血病(CLL)和小淋巴细胞淋巴瘤(SLL)刚获FDA授予孤儿药资格。
6.德琪医药1类新药在中国申报临床。德琪医药1类新药ATG-016片(eltanexor)临床试验申请获CDE受理。ATG-016是合作伙伴Karyopharm公司开发的一款二代SINE化合物,此次是ATG-016首次在华申报临床,拟开发适应症为高风险骨髓增生异常综合征(MDS)。ATG-016目前处于由Karyopharm公司开展的用于血液和实体恶性肿瘤的Ⅰ/Ⅱ期试验,涉及癌种包括高风险MDS、转移性结直肠癌(mCRC)、转移性去势抵抗性前列腺癌(mCRPC)及其他类型的晚期癌症。
国际药讯
1.CD19靶向抗体药物偶联物Lonca在美申报上市。ADC Therapeutics SA公司宣布,已向FDA提交了一款CD19靶向ADC疗法loncastuximab tesirine(Lonca,ADCT-402)的生物制品许可申请(BLA),用于治疗复发/难治性弥漫性大B细胞淋巴瘤(DLBCL)。在一项关键Ⅱ期LOTIS 2研究中,在先前接受的系统疗法中位数为3种的患者中,Lonca的客观缓解率(ORR)为48.3%、完全缓解率(CR)为24.1%。研究中Lonca的耐受性总体可控。
2.CRISPR/Cas9基因编辑疗法获优先药物资格。欧洲药品管理局授予CRISPR Therapeutics与Vertex公司联合开发的在研基因疗法CTX001优先药物资格(PRIME),用于治疗重度镰状细胞病(SCD)患者。CTX001是一种自体、体外CRISPR/Cas9基因编辑疗法,正在临床中评估用于治疗输血依赖性β地中海贫血(TDT)和重度SCD的潜力。目前CTX001治疗TDT和SCD已获得FDA授予再生医学高级治疗产品(RMA)、快速通道资格和孤儿药资格(ODD),以及欧盟委员会授予的ODD。
3.强生新冠疫苗JNJ-78436735启动Ⅲ期临床。强生旗下杨森开发的COVID-19候选疫苗JNJ-78436735(Ad26.COV2.S)已启动关键性Ⅲ期临床ENSEMBLE试验。该项研究将招募来自3个大洲的多达6万名18岁以上(包括60岁以上人群的代表)志愿者,评估单剂疫苗与安慰剂相比在预防COVID-19方面的安全性和有效性。JNJ-78436735已在Ⅰ/Ⅱa期临床中显示出良好的安全性和免疫原性。这些研究结果已提交给medRxiv,并即将在线发布。
4.诺华Zolgensma新剂型扩展适应症遭FDA拒绝。诺华基因疗法Zolgensma新的鞘内(IT)注射剂型扩展适应症使用人群的申请收到FDA的反馈信息,FDA无法接受其基于静脉注射(IV)剂型的Ⅰ/Ⅱ期临床数据进行的申请,并建议AVXS-101 IT剂型进行一项关键的Ⅲ期验证性研究,以进一步支持监管提交。FDA此前已批准的Zolgensma IV剂型可用于2岁以下的脊髓性肌萎缩症(SMA)儿童,而诺华希望新的IT注射剂型能将适应症扩展至5岁以下的患儿,并能在2021年完成上市申请,然而FDA的最新建议至少会把申请时间推迟到2023年。
5.罗氏早期阿尔茨海默症Ⅱ期临床失败。罗氏和合作伙伴AC Immune宣布其Tau抗体semorinemab治疗早期(无症或轻症)阿尔茨海默症的Ⅱ期TAURIEL研究失败。该研究评估使用79周semorinemab和安慰剂对患者认知功能的改善。试验一级终点是CDR-SB分值,次级终点是ADAS-Cog13和ADCS-ADL分值。结果显示,semorinemab错过所有这些疗效终点,但临床中安全性可控。目前,semorinemab用于治疗中期AD患者的Ⅱ期临床LAURIET仍在进行中。
医药热点
1.美国AACR发布2020年抗癌进展报告。今日,美国癌症研究协会(AACR)发布了2020年抗癌进展报告。癌症是世界上致病和致死的首要原因之一,2018年的数据统计显示,因为癌症导致的全球死亡人数占全球死亡总数的16%。AACR预计到2040年,全球的患者总数将达到2750万,并且有1630万患者因此去世。AACR报告中列举的导致癌症的主要风险因子包括吸烟、肥胖、酒精摄入、紫外线辐射、饮食习惯不良、特定病原体感染和不运动,并强调癌症筛查的重要性。
2.太阳药业召回二甲双胍缓释剂Riomet ER。受到致癌物杂质亚硝胺杂质N-亚硝基二甲胺(NDMA)的影响,糖尿病常用药物二甲双胍现已成为美国市场上遭遇召回的热门药品之一。本周,FDA在印度太阳药业旗下的糖尿病药品Riomet ER(盐酸二甲双胍缓释口服混悬液,500mg/5ml)中发现了高水平的致癌污染物,该公司也加入了召回二甲双胍的行列。被召回的批次包含747瓶药品,有效期至2021年10月。
3.国务院拟推进麻醉感染重症儿科等紧缺人才培养。国务院办公厅印发《关于加快医学教育创新发展的指导意见》,指出要把医学教育摆在关系教育和卫生健康事业优先发展的重要地位,并提出了四个方面17条改革举措。在“全面优化医学人才培养结构”方面,要求加强医学学科建设,推进麻醉、感染、重症、儿科等紧缺专业学科建设和人才培养;加大全科医学人才培养力度等。
4.10个团队被授予“时代楷模”称号。9月23日,中宣部发布抗疫一线医务人员英雄群体的先进事迹,并授予10个英雄群体“时代楷模”称号。分别为:国家援鄂抗疫医疗队(北京医院、北京协和医院、中日友好医院、北京大学第一医院、北京大学人民医院、北京大学第三医院),军队支援湖北医疗队,华中科技大学同济医学院附属同济医院“尖刀连”,中部战区总医院战“疫”党员突击队,辽宁、上海、广东支援雷神山医院医疗队,江苏省人民医院援武汉重症医疗队,四川大学华西医院援鄂重症救治医疗队,中国中医科学院国家援鄂抗疫中医医疗队,天津市对口支援恩施州疾控工作队,军事科学院军事医学专家组。
股市资讯
【海利生物】公司控股子公司杨凌金海生物技术有限公司全面恢复生产。
【新产业】公司新型冠状病毒核酸检测试剂盒取得欧盟CE认证。
【珍宝岛】公司的穿心莲内酯改构化合物收到美国专利局颁发的《专利授权证书》。
审评动向
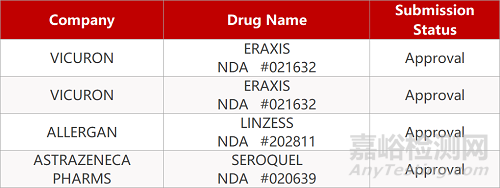
1. CDE最新受理情况(09月25日)

- The End -

来源:药研发


