您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-08-11 09:42
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「本文共:15条资讯,阅读时长约:3分钟 」
今日头条
Trevena注射用阿片类激动剂Olinvyk获FDA批准。FDA批准Trevena公司G蛋白选择性MU阿片受体激动剂Olinvyk(Oliceridine)上市,在医学监督情形下用于治疗成人中重度急性疼痛。在一项临床中,总共1,535例中重度急性疼痛患者接受了Olinvyk治疗。在进行过拇囊炎手术或腹部手术的患者的随机对照试验中,与安慰剂相比,使用Olinvyk的患者疼痛明显减轻,而且Olinvyk的安全性与其他阿片类药物相似。
国内药讯
1.华海奥美沙坦酯氢氯噻嗪片首仿即将获批。8月7日,华海药业在中国提交的4类仿制药奥美沙坦酯氢氯噻嗪片上市申请进入“在审批”阶段,有望近期获批成为国内首仿。奥美沙坦酯氢氯噻嗪片主要用于治疗高血压,原研公司为第一三共制药,于2003年6月在美国获批,2010年3月获批进入中国,商品名为复傲坦 。数据显示,2016年奥美沙坦酯氢氯噻嗪片美国市场销售额约为7.7亿美元,国内市场销售额约为1600万元。华海药业的奥美沙坦酯氢氯噻嗪片已于2017年4月获FDA批准上市。
2.正大天晴氟维司群注射液首仿即将获批。正大天晴4类仿制药氟维司群注射液上市申请进入在审批状态,预计即将获批成为国内首仿。氟维司群是一款雌激素受体(ER)下调剂,由阿斯利康原研开发,用于抗雌激素药物(如他莫昔芬)治疗后病情仍趋恶化的绝经后乳腺癌患者。目前该品种国内仅有原研产品获批上市。正大天晴的氟维司群注射液此前已分别在美国和德国获批上市。
3.杨森阿帕他胺第二个适应症在华即将获批。西安杨森阿帕他胺片在华的第二个上市申请变更为"在审批",有望近期获批上市,新适应症预计为转移性去势敏感性前列腺癌(mCSPC)。阿帕他胺(apalutamide,Erleada)是一款第二代雄激素受体(AR)抑制剂,属于《第二批临床急需境外新药名单》药品,已于2019年9月获NMPA批准用于治疗有高危转移风险的nmCRPC,商品名为安珂森。
4.达伯舒联合化疗一线治疗非鳞状NSCLC III期结果公布。信达与礼来联合开发的PD-1抑制剂达伯舒®(信迪利单抗注射液),联合力比泰®(注射用培美曲塞二钠)和铂类化疗,一线治疗非鳞状非小细胞肺癌(NSCLC)的III期研究ORIENT-11期中分析在线发表于《Journal of Thoracic Oncology》上。中位随访8.9个月时,达伯舒®联合治疗组和安慰剂联合治疗组经IRRC评估的中位无进展生存期分别为8.9个月和5.0个月,HR(95%CI)=0.482(0.362, 0.643),P<0.00001;两组中位总生存期尚未达到;由IRRC评估的客观缓解率由29.8%提高到51.9%;研究中无新的安全性信号。目前CDE已受理了该新适应症的申请(sNDA)。
5.贝达药业ALK抑制剂NSCLC达Ⅲ期临床终点。贝达药业控股子公司Xcovery Holdings在IASLC 2020会议上发布了其新一代ALK抑制剂盐酸恩沙替尼(Ensartinib、X-396)治疗ALK阳性非小细胞肺癌(NSCLC)的Ⅲ期临床eXalt3期中分析结果。与Xalkori(克唑替尼, 辉瑞)相比,Ensartinib显著延长患者的中位无进展生存期(25.8个月vs12.7个月),达主要终点指标;Ensartinib组只有不到40%患者出现进展,而Xalkori组有75%的患者进展。研究中, 观察到恩沙替尼最常见的副作用是造成晒伤样皮疹,这是观察到ALK抑制剂的“新毒性”。
6.BI泛KRAS抑制剂在华获批临床。勃林格殷格翰1类新药BI 1701963片获国家药监局临床试验默示许可,拟开用于局部晚期或转移性结直肠癌伴KRAS突变阳性患者。BI 1701963是勃林格殷格翰首款靶向所有主要KRAS突变体(pan-KRAS)的抑制剂,有望阻断15%的癌症中KRAS突变体的活性,目前正处于Ⅰ期临床开发阶段。勃林格殷格翰正在实施“中国关键”(China Key)项目,将中国全面纳入全球早期临床开发项目。
国际药讯
1.GSK抗HIV复方药Dovato获批扩展适应症。FDA已批准葛兰素史克(GSK)复方片剂Dovato(dolutegravir/lamivudine)扩展适应症,作为一种完整方案,用于治疗已实现病毒学抑制的HIV-1成人感染者(二线治疗)。具体为:作为一种完整方案,用于接受一种稳定的抗逆转录病毒(ARV)方案治疗已实现病毒学抑制(HIV-1 RNA<50拷贝/毫升)、无治疗失败史、对Dovato每个药物组分没有已知耐药性的HIV-1成人感染者,取代其当前的ARV方案。Dovato此前已获批用于一线治疗HIV-1成人感染者。
2.FDA批准首款使用NGS技术的液体活检。FDA批准Guardant Health公司开发的液体活检Guardant 360 CDx用于对所有实体瘤类型的综合基因组分析。FDA同时批准Guardant 360 CDx作为伴随检测,在转移性非小细胞肺癌(NSCLC)患者中,确定携带表皮生长因子受体(EGFR)基因特定类型突变的患者。这是首个FDA批准将新一代测序(NGS)和液体活检技术结合在一起,指导治疗决策的诊断测试。在关键性Ⅲ期临床FLAURA和AURA3的数据分析中,使用Guardant360 CDx确定进行Tagrisso治疗的NSCLC患者的无进展生存率与使用传统生物标志物检测确定的无进展生存率一致。
3.BMS胸膜间皮瘤一线双免疫疗法III期结果公布。8月8日在IASLC 2020会议上,百时美施贵宝宣布一项名为CheckMate-743的III期临床研究证实,纳武利尤单抗注射液联合伊匹木单抗能够显著改善既往未经治疗的、不可切除的恶性胸膜间皮瘤患者的总生存期(OS)。最短随访22个月时,这一联合疗法降低患者死亡风险26%,患者的中位OS为18.1个月,而化疗组为14.1个月(HR: 0.74,96.6% CI: 0.60, 0.91, p=0.002);联合治疗组患者2年生存率为41%,而化疗组为27%;研究中未观察到新的安全性信号。
4.Tecentriq联合紫杉醇未达三阴性乳腺癌III期研究终点。8月6日,罗氏宣布其Tecentriq联合紫杉醇用于一线治疗PD-L1阳性、转移性三阴性乳腺癌 (TNBC)的III期IMpassion131研究未达到无进展生存期(PFS)的主要终点。次要终点总生存期(OS)也呈阴性趋势,但目前数据还尚未成熟。罗氏表示针对OS的数据将继续随访,直到最终分析。Tecentriq联合紫杉醇的安全性与既往研究结果一致。详细数据将在医学会议上公布。
5.渤健和Denali达成帕金森病疗法研发合作。渤健和Denali Therapeutics就Denali的LRRK2小分子抑制剂DNL151达成一项合作。DNL151拟用于治疗帕金森病,目前正处于Ⅰb期开发阶段。根据协议,渤健将与Denali在美国和中国合作开发和共同商业化DNL151;渤健将负责所有其他市场的商业化过程;Denali将获5.6亿美元的前期付款,4.65亿美元的股权投资以及高达11.25亿美元的潜在里程碑付款。此外,利用Denal的生物大分子递送技术开发的神经退行性疾病研发项目,渤健还将获得选择加入两个研发项目的权利和两个额外项目的首轮谈判权。
医药热点
1.日本研究发现变异新冠病毒。据日媒《读卖新闻》报道,日本国立感染症研究所最新研究发现,今年3月日本新冠疫情主要是由欧洲相关基因序列的新冠病毒导致,但在5月下旬已暂时平息。6月中旬起,以东京为中心并向全国各地扩散的新冠病毒是变异后的、具有新型基因序列的新冠病毒。截至北京时间8日19时,日本当日新增新冠确诊病例1565例,连续两天单日新增病例超过1500例。
2.内蒙古巴彦淖尔市鼠疫Ⅲ级预警。8月8日,内蒙古自治区巴彦淖尔市卫健委对外发布信息,乌拉特前旗沙德格苏木毕克梯嘎查1例患者通过拨打包头市120急救电话到包头医学院第一附属医院就医。8月7日凌晨,该患者因多脏器衰竭,抢救无效死亡,经专家组会诊判定患者为腺鼠疫。目前巴彦淖尔市已发布鼠疫Ⅲ级预警,相关防控措施已全部落实(包括对7名密切接触者的集中隔离医学观察、预防性用药以及鼠疫核酸PCR检测等),预警时间从8月7日持续至2020年底。
3.3项职业资格不再由国家中医药局认定。日前,人力资源和社会保障部发布《关于对水平评价类技能人员职业资格退出目录有关安排进行公示的公告》,明确年内拟分批将76项水平评价类技能人员职业资格退出《国家职业资格目录》。其中包含药物制剂工、中药炮制工、保健调理师3项由国家中医药管理局组织实施认定的职业资格。公告提出,这些职业资格将转为社会化等级认定。
股市资讯
【艾德生物】公司与默克达成靶向药物临床研究合作:公司产品“肺癌多基因联合检测产品”将用于默克MET抑制剂Tepotinib在日本的伴随诊断注册。
【花园生物】公司拟向特定对象发行股票,发行数量为7171.92万股,发行价格12.68元/股,募集资金总额9.09亿元,本次发行完成后,将于2020年8月13日在深圳证券交易所创业板上市。
【迈克生物】细胞角蛋白19片段测定试剂盒(直接化学发光法)、胃泌素释放肽前体测定试剂盒(直接化学发光法)、糖类抗原50测定试剂盒(直接化学发光法)、鳞状上皮细胞癌抗原测定试剂盒(直接化学发光法)、神经元特异性烯醇化酶测定试剂盒(直接化学发光法)等五项产品取得产品注册证书。
审评动向
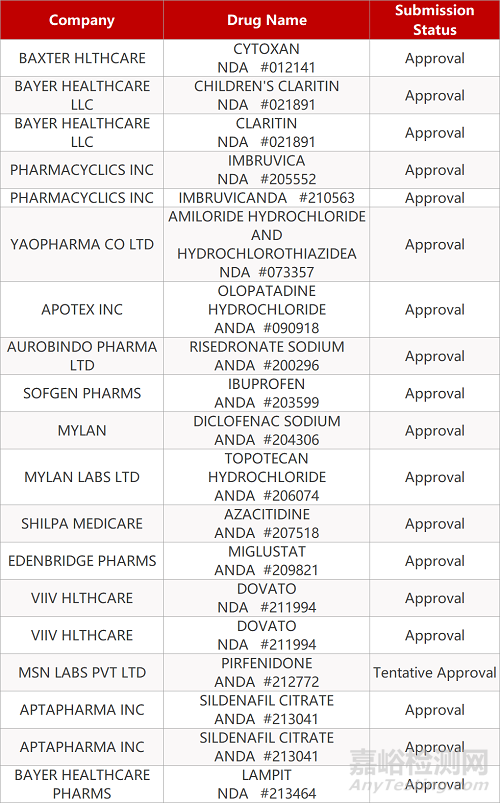
2. FDA最新获批情况(北美08月07日)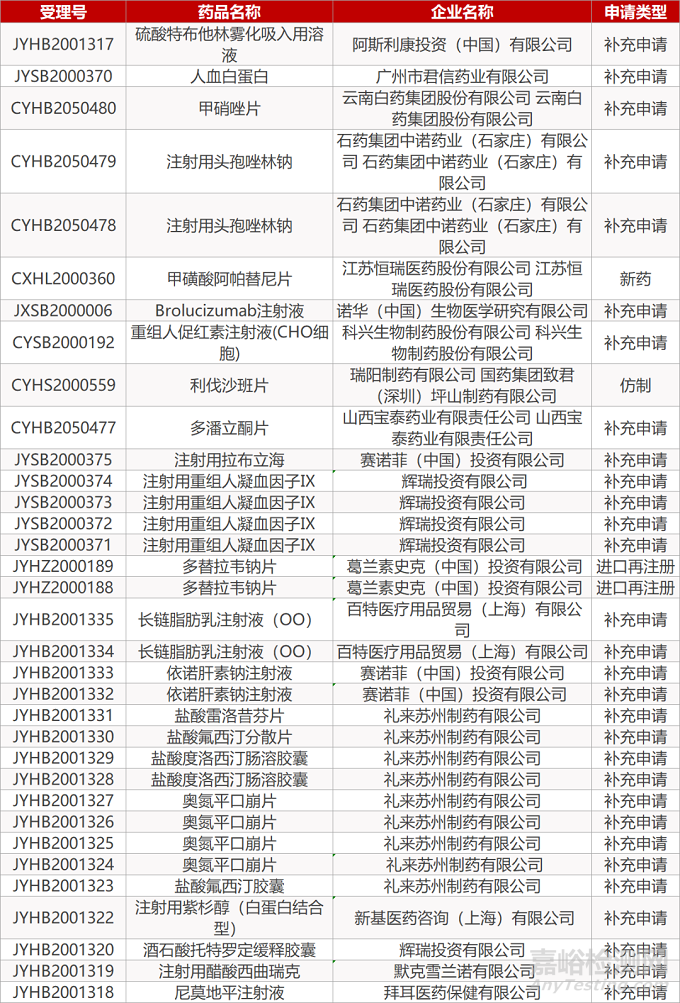
- The End -

来源:药研发


