您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-07-02 09:44
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「本文共:15条资讯,阅读时长约:3分钟 」
今日头条
国内药讯
1.药明巨诺CAR-T疗法申报上市。6月30日,药明巨诺提交的瑞基仑赛注射液上市申请获得CDE受理,为国内继复星凯特益基利仑赛之后第2款申报上市的CAR-T疗法。瑞基仑赛(研发代码:JWCAR029)是一款靶向CD19的CAR-T疗法。目前全球共有2款CAR-T疗法上市,分别为吉利德/复星凯特的Yescarta和诺华的Kymriah,靶点皆为CD19。2019年,Yescarta、Kymriah全球销售额分别约为4.56亿美元、2.78亿美元。
2.仙琚制药罗哌卡因一致性评价申请获受理。仙琚制药盐酸罗哌卡因注射液一致性评价申请获CDE受理。罗哌卡因是首个纯左旋体长效酰胺类局麻药,有麻醉和镇痛双重效应,在临床上适用于外科手术麻醉和急性疼痛控制。2019年在中国公立医疗机构终端罗哌卡因的销售额已超11亿,石四药的盐酸罗哌卡因注射液、山东华信制药的盐酸罗哌卡因氯化钠注射液于2020上半年获批并视同过评。
3.海正撤回盐酸伊立替康注射液上市申请。6月30日,海正药业发布公告称,收到国家药监局关于公司主动申请撤回盐酸伊立替康注射液药品注册申请的《审批意见通知件》。海正药业于2012年5月9日按原化药6类向浙江省药监局提交注册申请并获得受理。截至目前公司在该产品研发项目上已投入301.17万元左右。伊立替康注射剂适用于晚期大肠癌患者的治疗,2019年中国公立医疗机构终端伊立替康的销售额达18亿元。
4.信立泰2款新药申报临床。6月30日,信立泰2款新药(恩那司他片、重组人神经调节蛋白1-抗HER3抗体融合蛋白注射液(SAL007))临床申请获CDE受理。恩那司他片是信立泰从Japan Tobacco公司引进的一款口服活性低氧诱导因子脯氨酰羟化酶抑制剂(HIF-PHI),开发的适应症为肾性贫血,该药目前已在日本提交上市申请。SAL007是美国Salubris自主研发的NRG-1融合抗体药物,拟开发适应症为慢性心衰。该产品是信立泰第一个中美双报的创新生物药,目前正在美国开展人体临床试验。
5.辉瑞两款1类新药在华申报临床。辉瑞2款进口1类新药(PF-06865571和PF-05221304)首次在华申报临床试验,并获CDE受理。PF-05221304是一款处于Ⅱ期临床开发阶段的乙酰辅酶A-羧化酶(ACC)抑制剂,PF-06865571是一款处于临床Ⅰ期试验阶段的二酰基甘油O-酰基转移酶2(DGAT2)抑制剂,两个在研产品均为非酒精性脂肪性肝炎(NASH)治疗候选药。目前,全球还没有获批用于治疗NASH的药物。
国际药讯
1.FDA公布新冠疫苗开发指南。FDA发布COVID-19预防性疫苗的开发和批准指南。指南明确:候选疫苗在主要疗效终点的表现应至少优于安慰剂对照组50%;衡量候选疫苗有效性最直接的方法是能否为病毒感染提供保护的临床疾病终点;推荐在后期临床中使用独立的数据安全监控委员会(DSMB)对疫苗相关的ERD(呼吸系统疾病)等安全性信号进行监控;紧急使用授权(EUA)的授予将基于疫苗的使用人群、产品特征,临床前和临床研究数据等所有已知科学证据。FDA还建议将COVID-19重症病例数目作为临床试验的次要终点之一。
2.FDA批准罕见代谢疾病首款药物疗法。致力于开发罕见病创新疗法的Ultragenyx公司宣布,FDA已批准Dojolvi(triheptanoin,三庚酸甘油酯)作为卡路里和脂肪酸的来源,治疗通过分子诊断确认的长链脂肪酸氧化障碍(LC-FAOD)儿科和成人患者。LC-FAOD是一组威胁生命的罕见遗传性疾病,患者机体无法将长链脂肪酸转化为能量。Dojolvi是一种高纯度、人工合成的7碳脂肪酸甘油三酯,专门为LC-FAOD患者提供中链、奇数碳脂肪酸作为能源和代谢产物替代品。Dojolvi也是治疗这些患者的首款获批药物疗法。
3.默克/辉瑞PD-L1一线维持治疗尿路上皮癌获批。FDA批准默克与辉瑞联合开发的PD-L1抗体Bavencio(avelumab)的补充生物制品许可申请,用于一线维持治疗接受含铂化疗后未进展的局部晚期或转移性尿路上皮癌(UC)患者。这是首款在Ⅲ期临床中为这一患者群提供显著总生存期(OS)改善的一线免疫疗法。在一项Ⅲ期临床JAVELIN Bladder 100中,与最佳支持治疗(BSC)相比,Bavencio作为一线维持治疗和BSC联用,将中位OS显著改善7.1个月:21.4个月(95% CI:18.9至26.1)vs.14.3个月(95% CI:12.9至17.9);将总体人群的死亡风险降低31%。
4.辉瑞白血病药物Daurismo获欧盟批准。欧盟委员会批准辉瑞公司Hedgehog通路抑制剂Daurismo(glasdegib),与低剂量化疗药物阿糖胞苷(LDAC)联用,用于新诊断(无论新发或继发)的、不适合接受标准化疗的急性髓系白血病(AML)成人患者。在一项Ⅱ期临床试验BRIGHT 1003中,与LDAC单药相比,Daurismo与LDAC联用几乎增加了一倍的中位总生存期(8.3个月vs. 4.3个月,风险比 [HR] 0.463,95% CI [0.299,0.717]);并使死亡风险降低54%(HR:0.463,95% CI:0.299,0.717,单侧p值=0.0002)。Daurismo是首款获FDA批准治疗AML的Hedgehog信号通路抑制剂。
5.Inovio新冠疫苗Ⅰ期临床免疫反应率达94%。6月30日,美国生物技术公司Inovio披露其新冠疫苗INO-4800的Ⅰ期初步研究结果。36名18至50岁的健康成年人完成间隔四周接受1.0mg或2.0mg的INO-4800接种,基于评估体液(结合和中和)和T细胞免疫反应的初步数据,经独立的数据安全监控委员会评估有94%受试者对接种疫苗产生免疫反应;在第8周内,INO-4800展现出良好的安全性和耐受性,没有发生严重不良事件。
6.武田联手Carmine Therapeutics开发罕见病基因疗法。7月1日,Carmine Therapeutics (博泌生物)宣布与武田签署一项研究合作协议,利用Carmine Therapeutics的REGENT™技术(基于红细胞外囊泡)发现、开发和商业推广治疗两种罕见病的变革性非病毒基因疗法。根据协议,Carmine Therapeutics将获得预付款,总额超过9亿美元的分期付款以及分级版税。完成临床前验证研究后,武田可优先选择获得项目授权,并将负责临床开发和商业推广。此外,武田还提供了500万美元的可转换贷款,支持Carmine公司新的REGENT™平台的开发。
医药热点
1.美国单日新增确诊病例超5.9万例,系单日最大增幅。美国约翰斯·霍普金斯大学发布的疫情数据显示,截至北京时间7月1日6时30分左右,美国累计确诊新冠肺炎病例2623217例,累计死亡127258例。与前一日6时30分数据相比,美国新增确诊病例59054例,系单日最大增幅;新增死亡病例1330例。据根美国劳动统计局最新5月数据统计结果表明,当月就业人口比例下跌至52.8%,即美国人口中有47.2%于5月处于失业状态。
2.北京本轮新疫情重症患患比例偏低。6月30日,北京市新冠肺炎疫情防控工作新闻发布会通报,6月29日0时至24时,北京新增报告本地确诊病例7例。确诊病例定点收治医院、北京地坛医院副院长吴国安介绍,截至6月29日24时,该院累计收治危重症4例、重症20例,重症和危重症占7.4%,明显低于今年1月到4月收治患者的情况。目前该院参加救治的中医专业医护人员近30人,轻型和普通型患者以中医药治疗为主、西医对症治疗,重症和危重症采取中西医并重治疗,中医药治疗率达到100%。
3.新冠患者病亡或预后不佳的重要原因被发现。武汉大学中南医院通过对48例在中南医院和武汉雷神山医院重症病房治疗的新冠患者进行下肢深静脉血栓的筛查和临床研究,发现深静脉血栓在新冠肺炎危重症患者的发生率高达85.4%, 深静脉血栓的广泛形成可能是该类患者死亡或者预后不佳的重要原因。该成果日前在全球心血管顶级杂志《循环》在线发表。
股市资讯
【司太立】中国证监会核准公司非公开发行不超过7,048.68万股新股。
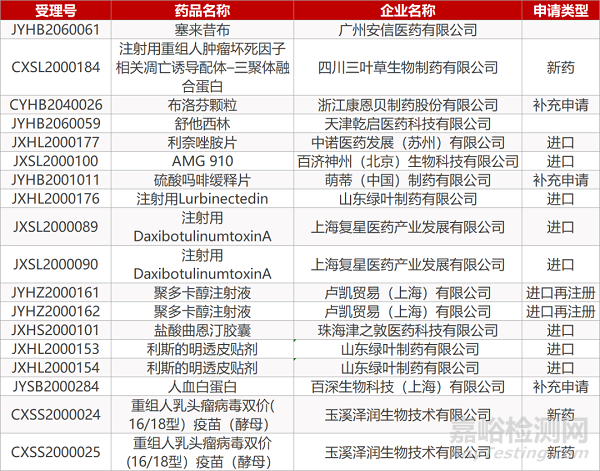
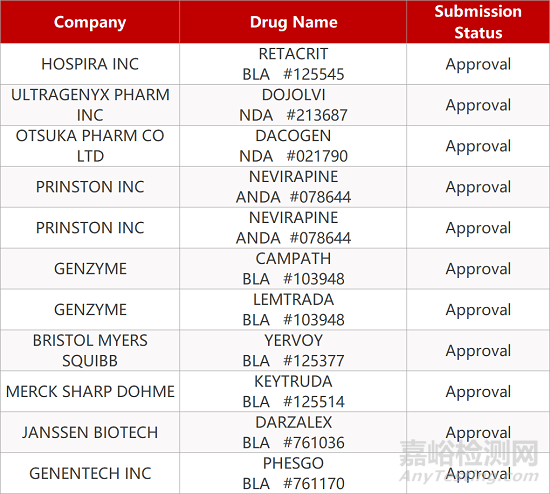
审评动向
- The End -

来源:药研发


