您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-05-15 10:18
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
化药注射剂仿制药一致性评价启动。5月14日,国家药监局发布《国家药监局关于开展化学药品注射剂仿制药质量和疗效一致性评价工作的公告》。公告明确,已上市的化学药品注射剂仿制药,未按照与原研药品质量和疗效一致原则审批的品种均需开展一致性评价。药品上市许可持有人应当依据《仿制药参比制剂目录》选择参比制剂,并开展一致性评价研发申报。
国内药讯
1.武田ADC药物安适利®获批上市。武田与西雅图遗传学公司联合开发的CD30靶向抗体偶联药物(ADC)安适利®(注射用维布妥昔单抗)获国家药监局批准,用于治疗CD30阳性的复发/难治系统性间变性大细胞淋巴瘤(sALCL)和经典型霍奇金淋巴瘤(cHL)成人患者。在2019 CSCO会议上公布的临床数据显示,维布妥昔单抗在cHL和sALCL中国患者中的总有效率均达到 70% 左右,且长期随访的无进展生存数据也很好。该药在美国已获批cHL、ALCL、外周T细胞淋巴瘤和蕈样肉芽肿等多种适应症。
2.再鼎肿瘤电场疗法获NMPA批准上市。再鼎医药与Novocure公司联合开发的肿瘤电场治疗产品爱普盾®获NMPA批准上市,用于与替莫唑胺联用治疗新诊断的胶质母细胞瘤患者,以及作为单一疗法用于治疗复发胶质母细胞瘤患者。爱普盾也是15年来中国内地首个获批用于胶质母细胞瘤的疗法。目前,该疗法用于治疗恶性胸膜间皮瘤(MPM)的新适应症已获FDA批准。除胶质母细胞瘤和MPM外,多个全球Ⅲ期关键性临床正在开展评估爱普盾用于治疗脑转移、非小细胞肺癌、胰腺癌和卵巢癌的疗效。
3.百济神州启动一项替雷利珠单抗联合疗法III期研究。百济神州登记启动替雷利珠单抗联合含铂双药化疗治疗可切除非小细胞肺癌的III期临床。该研究计划招募380例患者。主要终点为盲态中心病理评估的主要病理缓解率(MPR)和盲态独立中心评估无事件生存期( EFS ),次要终点为总生存期、完全病理缓解率、 客观缓解率等。替雷利珠单抗在中国已获批用于治疗霍奇金淋巴瘤和尿路上皮癌,该药联合紫杉醇与卡铂,或联合白蛋白紫杉醇与卡铂一线治疗晚期鳞状非小细胞肺癌的新适应症上市申请已获NMPA受理。
4.礼来/信达PD-1治疗食管鳞癌达Ⅱ期终点。信达生物与礼来联合开发的PD-1抑制剂达伯舒®(信迪利单抗)在二线治疗晚期食管鳞癌的Ⅱ期临床ORIENT-2中达到预设的主要终点。与化疗(紫杉醇或伊立替康)相比,信迪利单抗显著延长了患者总生存期(OS)并降低了死亡风险,安全性特征与既往报道的信迪利单抗研究结果一致,没有发现新的安全性信号。详细结果将在ASCO 2020年会上以壁报讨论(4511)的形式予以公布。
5.诺华2款新药在中国获批临床。诺华制药Tropifexor胶囊和LIK066片在中国获批临床,用于联合治疗非酒精性脂肪性肝炎(NASH)。LIK066(licogliflozin)是一种SGLT1/2抑制剂。Tropifexor是一种法尼酯X受体(FXR)激动剂,FXR是一种在肝肠系统等组织器官表达的胆汁酸受体,在胆汁酸代谢及胆固醇代谢中发挥重要作用。目前已经获批上市的同类型药物为奥贝胆酸。NASH是肝脏中脂肪过度蓄积引起的一种严重的进展性肝脏疾病,是诱发肝纤维化、肝硬化、肝功能衰竭、肝癌和死亡的主要原因。
国际药讯
1.默沙东公布Keytruda治疗霍奇金淋巴瘤Ⅲ期研究结果。默沙东在ASCO 2020年会上,公布重磅PD-1抑制剂Keytruda(pembrolizumab)治疗复发/难治性经典霍奇金淋巴瘤的Ⅲ期临床试验(KEYNOTE-204)阳性结果。研究纳入304例患者,随机接受Keytruda或brentuximab vedotin治疗。结果显示,Keytruda使疾病进展或死亡的风险降低了35%,中位PFS为13.2个月,而接受标准治疗的患者为8.3个月。默沙东计划在今年向全球监管机构提交这些数据。
2.强生公布Erleada关键性Ⅲ期临床最终结果。强生旗下杨森将在ASCO 2020年会上公布关键性Ⅲ期临床SPARTAN的最终分析结果。该研究在高转移风险的非转移性去势抵抗性前列腺癌男性患者中评估Erleada(apalutamide)与雄激素剥夺疗法(ADT)联用的效果。结果显示,与ADT疗法相比,Erleada联合ADT治疗可显着改善总生存期(OS),将患者中位OS期延长14个月(73.9个月VS 59.9个月),并使死亡风险降低22%。此外,该组合疗法的疗效也优于安慰剂+ADT治疗组,两组的中位数OS差异为21个月(73.9个月vs 52.8个月),并显著延迟了患者的细胞毒性化疗时间。
3.Capricor创新心脏细胞疗法达Ⅱ期临床终点。Capricor公司同种异体心脏来源细胞疗法CAP-1002,在治疗晚期杜兴氏肌营养不良症(DMD)的Ⅱ期临床HOPE-2中获积极结果。12个月的治疗数据显示,CAP-1002治疗组中患者的上肢表现测试(PUL 2.0)达到统计学意义上的显著改善,平均较安慰剂组高2.4个点;经射血分数和体积指数的测量,治疗组中患者的心脏功能也达到总体改善。值得一提的是,该试验首次在治疗DMD研究中证实心脏功能的稳定与细胞损伤生物标志物的减少有关。
4.诺和诺德索马鲁肽减肥III期临床达终点。诺和诺德公布索马鲁肽(semaglutide)用于伴有合并症的肥胖或超重患者持续体重管理的IIIa期临床STEP4的顶线结果。该研究为期68周,包括20周导入期和48周维持期。结果显示,试验达到了主要终点。在所有随机化患者中,继续接受semaglutide治疗48周的患者,平均体重从随机化时的基线继续降低了7.9%;安慰剂组患者的平均体重从随机化时的基线增加了6.9%,两组治疗差异具有统计学意义。接受semaglutide持续治疗68周(20周导入期+48周维持期)的患者,平均体重降低了17.4%。试验中,索马鲁肽安全性和耐受性良好。
5.“first-in-class”遗传性肥胖症疗法获优先审评资格。FDA受理Rhythm公司MC4R激动剂setmelanotide用于治疗阿片促黑皮质素原(POMC)和瘦素受体(LEPR)缺陷型肥胖症患者的新药申请,并授予其优先审评资格,预计11月27日做出回复。在2项Ⅲ期临床试验中,setmelanotide均达其主要终点和全部次要终点。在POMC型患者中,中位体重降低31.9公斤,与基线相比,中位体重和饥饿率分别下降25.4%和27.8%;50%患者饥饿指数的自我评分下降至少25%。在LEPR型患者中,中位体重降低16.7公斤,与基线相比,中位体重和饥饿率分别下降12.5%和41.9%;72.7%患者饥饿指数的自我评分下降至少25%。
6.CAR-T细胞疗法ide-cel上市申请遭FDA拒绝受理。FDA拒绝受理百时美施贵宝(BMS)与蓝鸟生物联合开发的CAR-T细胞疗法idecabtagene vicleucel(ide-cel,bb2121)提交的生物制品许可申请(BLA)。ide–cel是一款BCMA靶向的CAR-T疗法,今年3月提交的BLA申请寻求批准ide-cel用于治疗既往接受至少三种疗法(包括免疫调节剂、蛋白酶体抑制剂、抗CD38抗体)的多发性骨髓瘤成人患者。经初步审查后,FDA认为BLA中的化学、制造和控制(CMC)模块需要进一步细节来完成审查。BMS计划在2020年7月底之前重新提交BLA。
医药热点
1.“全球最贵药物”被日本纳入医保。5月13日,日本厚生劳动省将诺华的一次性基因疗法Zolgensma列为公共医疗保险适用对象,药价为1.6707亿日元(约合人民币1102万元)。Zolgensma用于治疗2岁以下的抗AAV9抗体为阴性的脊髓性肌萎缩症儿童患者(包括在诊断时为症状前的患者)。在美国上市时一剂就要210万美元(约合1448万元人民币),被媒体称为有史以来最昂贵的药物。据报道,日本未满2岁患者的公共保险医疗费窗口自付比例为2成,由于日本中央及地方政府有补贴制度,事实上几乎无需自费。
2.美国疫情期间消毒剂中毒事件飙升。美国《时代》周刊12日援引毒物控制中心协会数据报道,今年1月、2月和3月,家用消毒剂意外中毒事件同比分别增加5%、17%和93%;4月意外中毒事件同比增加121%;5月前10天,情况有所好转,意外中毒事件同比增加69%。在同比增幅最高的4月,美国总统特朗普曾在一次记者会上“即兴”提议“注射消毒剂”以帮助感染者清除病毒,引发争议。多个消毒剂品牌警告民众,不要注射或吞咽旗下消毒产品。
3.世卫组织:新冠病毒或永远不会消失。根据世卫组织最新实时统计数据,截至欧洲中部夏令时间5月13日18时50分,全球新冠肺炎确诊病例累计4179479例,死亡287525例,中国以外超过409万例。当地时间13日,在日内瓦举行的新闻发布会上,世卫组织卫生紧急项目负责人迈克尔·瑞安表示,新冠病毒可能成为长期问题,很难预测何时可以战胜病毒,它可能成为永远不会消失的流行性病毒。世卫组织总干事谭德塞提出建议,敦促所有国家保持最高警戒。
股市资讯
【海思科】公司及公司全资子公司四川海思科制药有限公司、辽宁海思科制药有限公司的创新药HSK21542注射液于2020年5月13日获得国家药品监督管理局药品审评中心下发的《临床试验通知书》。
【九强生物】持股 5%以上股东于2019年4月11日至2020年5月14日通过集中竞价交易、大宗交易方式合计减持509.2523万股,累计减持占总股本 1.01%。
【康辰药业】公司拟以自有资金向全资子公司康辰生物增资52,300万元、提供借款38,000万元。
审评动向
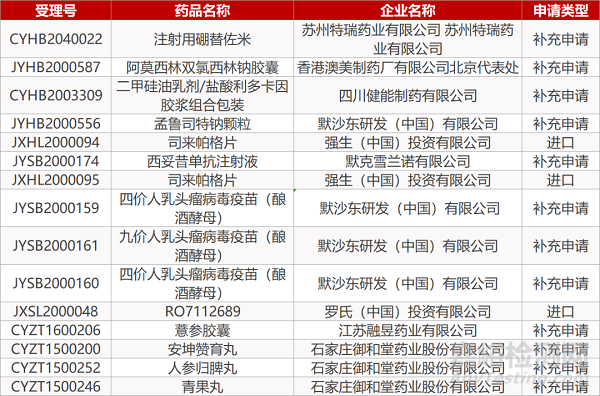
1. CDE最新受理情况(05月14日)
- The End -

来源:药研发


