您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-01-03 09:08
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「本文共:14条资讯,阅读时长约:3分钟 」
今日头条
迈博药业英夫利西单抗提交上市申请。迈博药业向国家药监局提交了CMAB008(英夫利西单抗)的上市申请。CMAB008是基于英夫利西单抗的一种重组抗TNF-alpha嵌合单克隆抗体,用于治疗中重度活动期类风湿性关节炎,采用与目前已上市英夫利西单抗药不同的CHO表达系统。目前通过CMAB008临床结果与现已上市的英夫利西单抗公布结果比较显示,CMAB008能够大幅降低免疫原性,并在治疗中重度活动性类风湿关节炎方面与现已上市的英夫利西单抗药同样有效。英夫利西单抗原研药是强生的类克,于1998年获FDA批准上市,2006年获批进口中国,2018年中国样本医院销售额为1.5亿元
国内药讯
1.海力生坦索罗辛通过一致性评价。仟源医药子公司海力生制药的盐酸坦索罗辛缓释胶囊通过仿制药一致性评价并获国家药监局核发的《药品补充申请批件》。盐酸坦索罗辛缓释胶囊是一种选择性的肾上腺素α-1A受体拮抗剂,主要用于治疗成人前列腺增生症引起的排尿障碍,是目前治疗该疾病的一线主要用药,已列入国家医保目录和国家基本药物目录。海力生制药是继恒瑞之后第2家通过该药一致性评价的厂家。
2.阿斯利康环硅酸锆钠散在华获批上市。阿斯利康的环硅酸锆钠散(ZS-9 )获国家药监局批准上市,用于治疗成人高钾血症。ZS-9是一种钾结合剂,最初由美国ZS制药公司开发。一项IIIb临床试验DIALIZE结果表明,ZS-9治疗组中有41.2%的患者比例在4次透析治疗中至少有3次能够维持透析前的正常血钾水平,而安慰剂组仅有1%,到达主要终点。今年5月环硅酸锆钠散已被纳入《第二批临床急需境外新药名单》。
3.科兴生物水痘疫苗获批上市。科兴生物水痘疫苗产品获国家药监局批准上市,用于1-12岁儿童预防水痘-带状疱疹病毒感染。科兴公司的水痘疫苗是从Oka株中提取的,并在该公司专有的人类二倍体细胞中进行。一项III期疗效研究显示,该疫苗的保护率为87.1%,研究成果发表在《临床微生物学与感染》杂志上。水痘是由水痘-带状疱疹病毒引起的一种高度传染性疾病。通过直接接触或通过呼吸道飞沫传播。
4.礼来糖尿病新药tirzepatide在华提交18项临床项目。礼来(Eli Lilly)2型糖尿病在研药物tirzepatide注射液的6项临床试验申请获国家药监局受理。Tirzepatide是一种靶向GIP和GLP-1受体的双重激动剂,已在中国共计提交18项临床试验申请,其中有6项已获临床试验默示许可,适应症为2型糖尿病。根据在2019 ADA大会上公布的临床试验数据,tirzepatide能够显著降低患者糖化血红蛋白(HbA1c)水平、体重和胃肠道副作用,同时能够改善与NASH相关的生物标志物水平。目前,tirzepatide用于治疗2型糖尿病正处于Ⅲ期临床开发阶段。
5.年度盘点:2019中国药企在美获批ANDA排行榜。2019年,中国药企获得FDA批准的ANDA达92个申请号,共计76个活性成分,来自28家药企。获批ANDA最多的是复星医药,凭借旗下Gland和重庆药友,达到16个申请号;其次是南通联亚,申请号数达到12个。从数量来看,复星医药、南通联亚、海正药业、景峰医药相对于2018年均出现了明显的增长。而去年排行前三的东阳光、人福医药、华海药业均出现了明显下降。东阳光从15个降至了7个;人福医药从13个降至4个;华海药业也从11个降至4个。
国际药讯
1.Lexicon公司SGL1/2抑制剂Zynquista III期临床成功。Lexicon公司SGLT 1/2抑制剂Zynquista(sotagliflozin)治疗2型糖尿病III期SOTA-EMPA研究结果积极。在以往接受DPP4抑制剂治疗但血糖水平控制不佳的2型糖尿病患者中,治疗第26周,与安慰剂相比,sotagliflozin(400mg)在降低血糖水平方面显示出优越性;治疗第26周,与empagliflozin(恩格列净)(25mg)相比,sotagliflozin(400mg)在降低血糖水平方面显示出非劣效性。研究中,sotagliflozin的耐受性良好,安全性结果与先前报道的结果一致。SOTA-EMPA研究是sotagliflozin治疗2型糖尿病项目9项核心III期研究中的第4项,该研究的全部结果将在即将召开的医学会议上公布。
2.Axsome新型双重机制药物AXS-07 III期临床成功。Axsome公司新型双重机制药物AXS-07( MoSEIC美洛昔康/利扎曲普坦)用于偏头痛急性治疗的III期MOMENTUM试验达到2项监管共同主要终点。在给药后2小时,AXS-07治疗组与安慰剂组相比,有更高比例的患者实现疼痛消除(19.9% vs 6.7%,p<0.001)和无最烦人症状(36.9% vs 24.4%,p=0.002);AXS-07相对于利扎曲普坦、MoSEIC美洛昔康、安慰剂,在给药后2-24小时有更高比例的患者实现持续疼痛消除(16.1%、11.2%、8.8%、5.3%;p=0.038、p=0.001、p<0.001)。Axsome公司计划明年下半年向FDA提交AXS-07用于偏头痛急性治疗的新药申请。
3.礼来RET激酶抑制剂selpercatinib启动第二项III期临床。礼来(Eli Lilly)宣布启动III期LIBRETTO-531临床试验(NCT04211337),评估口服RET激酶抑制剂selpercatinib一线治疗RET突变甲状腺髓样癌(MTC)患者。这是评估selpercatinib的第二项III期研究。之前,礼来已启动首个III期LIBRETTO-431,评估selpercatinib一线治疗RET融合阳性非小细胞肺癌(NSCLC)患者。一项I/II期临床LIBRETTO-001结果显示,selpercatinib在初治和经治的RET突变MTC患者中的ORR分别为59%和56%。之前公布的NSCLC队列数据显示,selpercatinib在初治、经治RET融合阳性NSCLC患者中的ORR分别为85%、68%。
4.Arrowhead第二代皮下RNAi疗法临床新进展。Arrowhead第二代皮下RNAi疗法ARO-AATII期AROAAT2002(NCT0394449)研究已完成首例患者给药。该研究旨在评估AATD(α-1抗胰蛋白酶缺乏)相关肝病患者中ARO-AAT应答的新组织学活性量表的变化。大约12例受试者将入组两个贯续队列。所有符合资格的受试者都需要进行给药前活组织检查和研究结束活组织检查。接受治疗的受试者还将有机会继续接受开放扩展(OLE)治疗。包括OLE,新组织学评级量表的变化将在ARO-AAT治疗6个月、12个月、18个月和24个月后进行评估。
5.BMS抗PD-1疗法联合微生物组疗法临床研究开展。Vedanta Biosciences公司启动微生物组疗法VE800的首个人体临床研究,评估该疗法联合BMS抗PD-1疗法Opdivo用于治疗晚期或转移性黑色素瘤、胃/胃食管交界腺癌或微卫星稳定性(MSS)结直肠癌患者的安全性和耐受性,以及采用确认的总缓解率(ORR)评估其临床活性等。研究预计到2021年取得顶线结果。微生物组疗法VE800由11种共生细菌菌株组成,它们共同激活细胞毒性CD8+T细胞(产生有效免疫治疗的关键驱动因素)。
医药热点
1.医养结合机构有了服务指南。国家卫健委等多部门联合印发《医养结合机构服务指南(试行)》,明确了医养结合机构(指兼具医疗卫生资质和养老服务能力的医疗机构或养老机构)的基本要求、服务内容、服务流程,旨在提高服务质量,规范服务内容。《指南》要求,医养结合机构应当具备医疗机构执业许可或在卫生健康行政部门(含中医药主管部门)进行备案,并在民政部门进行养老机构登记备案。
2.上海奖励举报非法行医者。上海市卫健委、财政局联合发布《上海市非法行医举报奖励办法(试行)》,鼓励社会公众积极举报非法行医行为。《办法》明确了经核实并查处的8种情况属于奖励范围。奖励标准根据举报人提供的线索与事实相符合的程度、社会危害性及对非法行医行为罚没款金额来确定,分别对举报人给予500元~5000元的一次性奖励。市、区卫健部门对举报人进行奖励的资金,按照处理机构行政隶属关系各自编入部门预算,市、区财政部门分别按规定核拨。
3.青海城乡居民“两病”用药最高可报销60%。青海省近日出台《关于完善城乡居民高血压糖尿病门诊用药保障机制的实施方案》和《全省城乡居民高血压糖尿病门诊用药支付标准》两项新政策,为参加城乡居民医疗保险、经二级及以上定点医疗机构确诊为高血压、糖尿病,需要采取药物治疗且未纳入门诊慢性病保障范围的“两病”患者提供保障。“两病”门诊用药医保不设起付线,患者在二级、一级及以下定点医疗机构使用两药的报付比例分别为50%、60%,年度内“两病”门诊用药最高支付限额为400元、600元,同时患有“两病”的最高支付限额为1000元。
股市资讯
【恒瑞医药】收到药监局核准签发的《药品注册批件》,药品名称:注射用甲苯磺酸瑞马唑仑,本次获批的适应症为常规胃镜检查的镇静。
【羚锐制药】监事李进计划于本减持计划披露之日起15个交易日后的6个月内,通过集中竞价交易方式减持所持公司股份,减持数量不超过8.5万股,即不超过公司总股本的0.0149%,减持价格将按照减持实施时的市场价格确定。
【普洛药业】聘任徐新良先生为公司总经理,聘任金旻先生为公司高级副总经理,聘任汤二庆先生和何春先生为公司副总经理。
审评动向
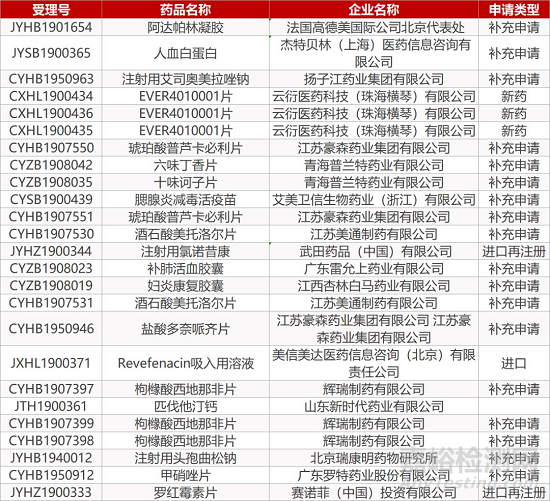
1. CDE最新受理情况(01月02日)
2. FDA最新获批情况(北美01月02日)
暂无

来源:药研发


