您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2019-09-11 10:55
近日,器审中心发布了国内首款人工心脏(植入式左心室辅助系统)技术评审报告,全文如下:
产品中文名称:植入式左心室辅助系统
产品管理类别:第三类
申请人名称:重庆永仁心医疗器械有限公司
一、产品概述
(一)产品结构及组成
该产品由体内部件、体外部件、手术工具组成,其中体内部件 包括血液泵组件(含泵缆)、入血管、出血管,体外部件包括控制 器、控制器连接元件、纯水密封构成组件、纯水密封流路清洗组件、 AC/DC适配器、电池、充电器、紧急备用电池、备用控制器、外部 监控器、外部监控器底座、外部监控器连接线缆、操作钥匙,手术 工具包括隧道刀、穿孔器、手术扳手、解剖器。
(二)产品适用范围
该产品用于为进展期难治性左心衰患者血液循环提供机械支持, 即心脏移植前或恢复心脏功能的过渡治疗以及长期治疗。供具备心 脏移植条件与术后综合护理能力的医疗机构使用,医务人员、院外 护理人员以及患者须通过相应培训。抗凝治疗不耐受患者禁用。
(三)型号/规格
EVAHEART Ⅰ
(四)工作原理
该产品通过入血管将血液由左心室引入血液泵,由血液泵叶轮转动产生的离心力将血液从血液泵内排出,经出血管流至升主动脉, 从而支持患者血液循环,详见图1。
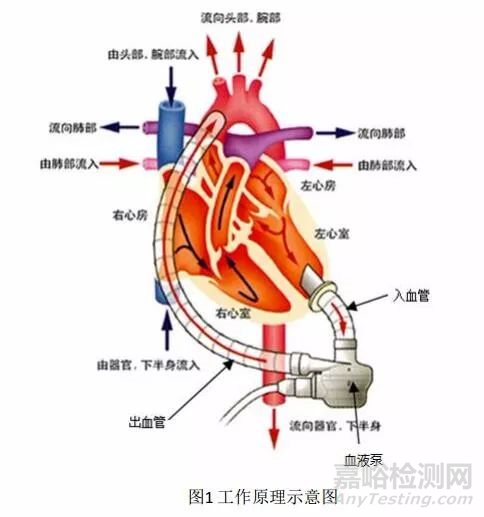
二、临床前研究摘要
(一)产品性能研究
该产品性能指标包括血液泵、出入血管、控制器、纯水密封构 成组件、手术工具、软件功能、物理性能、化学性能、无菌、环境 试验、电气安全、尺寸重量、材质、连接性能、极端条件响应、耐 久性等要求。申请人提交了该产品与日本已上市产品实质等同性分析报告、 流体动力学仿真计算报告、流场可视化分析报告、MPC涂层研究报 告、耐久性研究报告等资料,并提交了产品技术要求与产品检测报 告,检测结果与产品技术要求相符。
(二)生物相容性
该产品体内部件所含血液泵、出入血管与血液持久接触,泵缆 与组织持久接触,体外部件所含纯水密封构成组件与血液持久接触, 手术工具与血液短期接触。申请人按照GB/T 16886系列标准要求开展了生物相容性评价, 包括细胞毒性、皮内反应、皮肤致敏、急性全身毒性、亚慢性毒性、 遗传毒性、植入、血液相容性,证实该产品生物相容性风险可接受。
(三)灭菌
该产品体内部件全体及体外部件所含控制器连接元件、纯水密 封构成组件、纯水密封流路清洗组件采用环氧乙烷灭菌,手术工具 均采用湿热灭菌,其中穿孔器为一次性使用,解剖器、隧道刀、手 术扳手为重复使用。申请人提交了灭菌确认报告,证实所用灭菌方法可实现有效灭菌, 且不会影响产品使用性能。
(四)产品有效期和包装
申请人提交了产品有效期研究资料,其中血液泵组件、控制器 连接元件、纯水密封构成组件、纯水密封流路清洗组件、隧道刀、 手术扳手、解剖器的无菌货架有效期为2年,入血管、出血管、穿 孔器的无菌货架有效期为37个月。申请人提交了产品包装验证报告,证实包装完整性符合设计要求。
(五)动物实验研究
申请人采用牛模型开展了三次动物实验,分别验证产品的机械 稳定性与血液相容性、抗血栓性能、耐久性,包括血液泵运转性能 与轴密封性能、血液指标、血栓形成情况、内皮化情况、长期稳定 性等评价,实验结果表明产品能够达到预期设计要求。
(六)软件研究
该产品软件安全性级别为C级,控制器软件发布版本为1.4,完 整版本为1.4.0;备用控制器软件发布版本为2.0,完整版本为2.0.2;外部监控器软件发布版本为2.3,完整版本为2.3.2。申请人按照《医 疗器械软件注册技术审查指导原则》要求,提交了相应级别的软件 描述文档和软件版本命名规则真实性声明,证实该产品软件设计开发过程规范可控,剩余风险均可接受。申请人根据《医疗器械网络安全注册技术审查指导原则》要求, 提交了网络安全描述文档,证实该产品现有网络安全风险可控,已 建立网络安全应急响应计划。
(七)产品符合的相关标准
该产品符合以下安全标准要求:
GB 9706.1-2007 医用电气设备第1部分:安全通用要求
GB 9706.15-2008 医用电气设备第1-1部分:安全通用要求并列 标准:医用电气系统安全要求
YY 0505-2012 医用电气设备第1-2部分:安全通用要求并列标 准:电磁兼容要求和试验
YY 0709-2009 医用电气设备第1-8部分:安全通用要求并列标 准:通用要求医用电气设备和医用电气系统中报警系统的测试和指 南
GB 16174.1-2015 手术植入物有源植入式医疗器械第1部分:安 全、标记和制造商所提供信息的通用要求。申请人提交了相应检测报告,证实该产品符合上述安全标准要 求
三、临床评价摘要
申请人根据《医疗器械临床试验质量管理规范》规定开展了临 床试验研究,采用前瞻性、多中心、单组目标值对照设计,选取3 家具有医疗器械临床试验实施资质的医疗机构开展试验研究,受试 者为具备心脏移植条件的处于等待心脏移植供体期间的终末期/重症 心力衰竭患者,结合中国心脏供体等待时间情况以3个月生存率为 主要评价指标。
该产品属于治疗严重危及生命且尚无有效治疗手段疾病急需的 医疗器械,申请人提交了阶段性临床试验资料,病例数满足临床试 验方案统计学要求,3个月生存率为100%,不良事件均为手术常见 并发症,与试验产品无关,可证明该产品安全有效性符合临床要求。申请人提交了日本已上市产品的临床使用数据,171例平均辅 助时间919天,可证明该产品能够用于进展期难治性左心衰患者的 长期治疗(>2年)。
四、风险分析与说明书提示
(一)风险分析
申请人识别了产品风险,采取了相应风险控制措施,提交了风 险管理资料,证实该产品剩余风险均可接受。
(二)警示及注意事项
使用本产品的患者需持续进行抗凝治疗,不能接受磁共振检查, 日常生活应避免剧烈运动,禁止倒立,禁止乘坐游乐设施,不能盆 浴(含桑拿浴)、游泳。严格遵守本产品的保管及使用环境条件, 避免进入干扰本产品运行的区域。孕妇不建议使用本产品,已使用本产品的患者应当避免怀孕。使用本产品的患者或其护理人员发觉患者身体或产品异常时, 尤其出现脑血管疾病征兆症状时,应立即联系医疗机构进行处置。本产品与其他有源医疗器械共同使用时务必咨询医疗机构。其他警示及注意事项详见说明书。
(三)禁忌症
❶.绝对禁忌症
1)存在可逆的心衰病因。
2)终末器官或多器官功能衰竭,包括即将发生的肾或肝功 能衰竭(多器官移植候选者除外)。
3)有活跃的感染灶,但原有植入式血泵传动系统感染除外。
4)罹患进行性脑血管疾病或神经功能缺陷,无法进行产品 管理,例如:不能日常活动,无法康复治疗,认知功能障碍。
5)预测FEV1<30%的严重肺部疾病。
6)终末期患者,如恶性肿瘤广泛转移或肝硬化。
❷.相对禁忌症
1)年龄>75岁,但无其他临床风险因素者除外,例如:存在 双心室衰竭的高风险,其他严重合并症。
2)慢性肾脏疾病IV期,血清肌酐>3.0mg/dL。
3)严重的慢性营养不良,例如男性BMI<21kg/m2,女性 BMI<19kg/m2,两者的前白蛋白<15ml/dL。
4)不耐受或抗凝禁忌。
5)高出血风险。
6)病态肥胖(BMI>40kg/m2)。
7)由于以下原因,康复潜力较差:相关合并症,神经系统 问题。
8)有以下历史:不稳定的精神疾病,社会支持不足,可能 会影响维护或操作产品能力的不合规项。
五、受益-风险评估
该产品临床受益主要包括:
1)药物或短期机械循环支持无法 改善的难治性左心衰患者可得到缓解或治愈;
2)可用作部分难治 性左心衰患者心脏移植前的过渡治疗;
3)可用作部分难治性左心 衰患者的长期治疗;
4)能够为复杂心脏病治疗提供额外选择。
该产品的临床风险主要包括:
1)感染、出血、血栓、右心衰、 主动脉瓣损毁等并发症所产生的风险,通过规范的临床管理体系进行风险控制,特别是术后综合护理能力建设;
2)产品故障导致的 风险,通过冗余设计(如多重电源、紧急备用电池、备用控制器等) 和日常维护进行风险控制;
3)产品临床使用经验较少导致的风险, 通过专业培训进行风险控制,包括医务人员、院外护理人员以及患 者。临床使用需进一步评估产品剩余风险。
综上,该产品因具有转速低、流量高等特点,可减少溶血风险 并可产生脉动血流,具有显著的临床受益,同时临床主要风险已得 到识别和控制,可认为该产品临床使用受益大于风险。

来源:中国器审


