您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2019-08-16 16:02
水是药品生产中用量大、使用广的一种辅料,用于生产过程及药物制剂的制备。水在纯化、贮存和使用过程中,容易被微生物污染,微生物或其代谢产物会严重影响药品质量,引起不良后果。目前,《中国药典》、《美国药典》、《英国药典》、《欧洲药典》均收载了制药用水的微生物检查方法,但其所用培养基存在较大差异。笔者采用不同培养条件,进口和国产2种培养基(TSA培养基和R2A培养基),薄膜过滤法和平皿法2种实验方法,分别对采集自陕西4家制药单位的不同水系统的20份样品进行计数实验。为得到具有统计意义的数据,本次实验尽可能考虑了微生物污染水平,从预估污染严重的取水口连续取样1000mL至灭菌瓶中,及时送达实验室进行实验,以确保结果的准确、可靠。通过比较中外药典制药用水微生物检查法的差异,为《中国药典》的修订提供参考,为推动制药用水检查法与国际接轨提供合理化建议,优化标准。
1、仪器与试药
1.1仪器LRH-250型生化培养箱(上海一恒科技有限公司);LRH-150B型生化培养箱(广东医疗器械厂);SHH-250JS型霉菌培养箱(重庆四达实验仪器厂);MLS-3020型高压蒸汽灭菌锅(日本三洋公司)。
1.2试药TSA培养基(MerckKGaA德国默克公司,批号VM440558232);TSA培养基(青岛海博高科园生物技术有限公司,批号20120730);R2A培养基(MerckKGaA德国默克公司,批号VM401316218);R2A培养基(青岛海博高科园生物技术有限公司,批号20120730);营养琼脂培养基(北京三药科技开发公司,批号120425);玫瑰红钠琼脂培养基(北京三药科技开发公司,批号1111022);pH7.0氯化钠-蛋白胨缓冲液(北京三药科技开发公司,批号120509)。以上培养基和稀释液采用规定的灭菌程序进行高压蒸汽灭菌备用,培养基的适用性检查符合《中国药典》2010年版规定。水样品20份每份1000mL。
2、方法与结果
2.1实验方法取每份水样品,摇勻,薄膜过滤法,100mL/膜,过滤,不冲洗,制备4份薄膜,分别贴于预先制备好的进口及国产TSA、R2A培养基平皿上,A、B、E、F检测条件各制备1张薄膜。采用平皿法,分别量取相同水样1.0mL,置于8个无菌平皿中,分别倾倒预热至45V的进口及国产TSA、R2A培养基,摇勻,C、D、G、H检测条件各平行制备2个平皿。另外取水样,1mL/膜,加人100mL稀释液中,薄膜过滤法,过滤,不冲洗,分别贴于预先制备的营养琼脂培养基和玫瑰红钠琼脂培养基,按I、J检测条件培养。以上平皿按表1检测条件培养,逐日观察并记录结果,规定平皿法所测数值保留小数点后1位,薄膜过滤法取样量为100mL时,需进行数据转换后保留小数点后1位进行比较分析。
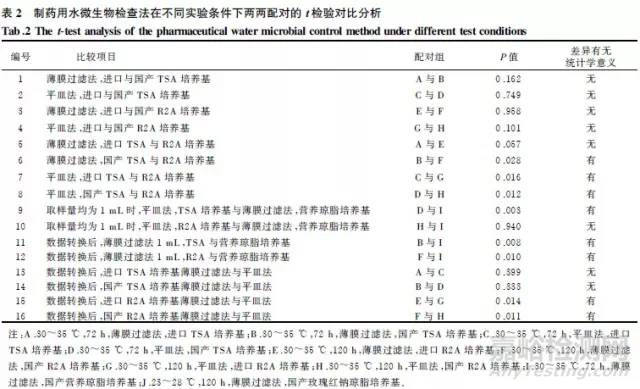
2.2实验结果20份水样品在不同培养条件下的计数结果如表1所示。采用SPSS13.0软件进行统计分析,对不同培养条件进行两两配对的t检验,P值大于0.05表示差异无统计学意义;反之,则差异有统计学意义。
2.2.1比较进口与国产TSA、R2A培养基2种培养条件的计数结果A与B、C与D、E与F、G与H进行两两配对的样本t检验,结果表明本次实验国产与进口的同种培养基两两之间差异均无统计学意义(P>0.05)。
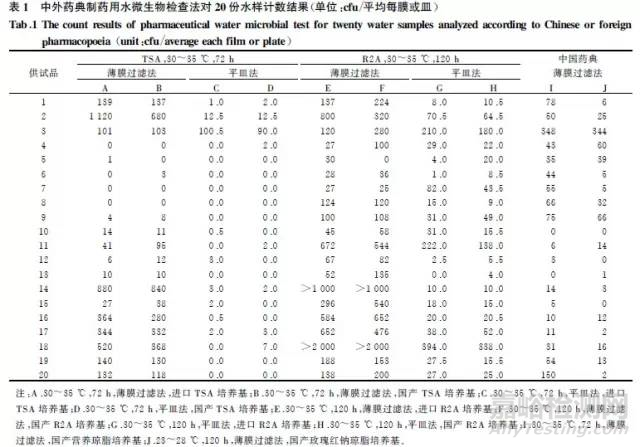
2.2.2比较R2A和TSA培养基2种培养条件的计数结果A与E、B与F、C与G、D与H进行两两配对的t检验,结果表明,采用进口R2A和TSA培养基,薄膜过滤法,检测结果A与E差异无统计学意义(P>0.05);采用国产R2A和TSA培养基,薄膜过滤法,检测结果B与F差异有统计学意义(P<0.05),且R2A培养基检测数据高于TSA培养基;采用国产和进口TSA和R2A培养基,平皿法,不同种培养基的检测结果C与G、D与H差异有统计学意义(P<0.05),且R2A培养基的检测结果高于TSA培养基。
2.2.3比较TSA、R2A培养基培养条件与营养琼脂培养基培养条件的计数结果D与I、H与I进行两两配对的t检验,结果D与I差异有统计学意义(P<0.05),说明取样量1mL,薄膜过滤法/平皿法处理后,均采用国产培养基,检测结果明显不同,且营养琼脂培养基检测结果高于TSA培养基,H与I差异无统计学意义(P>0.05),说明采用平皿法R2A培养基检测结果与营养琼脂培养基检测结果相似。
2.2.4比较数据转换后,薄膜过滤法1mL,TSA、R2A与营养琼脂培养基培养条件的计数结果由于B与I、F与I的取样量不一致,数据转换后,对B与I、F与I进行两两配对的t检验,结果表明,其差异均有统计学意义(P<0.05),结合表1数据,说明采用薄膜过滤法TSA、R2A、营养琼脂培养基检测结果有明显差异,且营养琼脂培养基检测数值较高。
2.2.5比较数据转换后,同种培养基薄膜过滤法与平皿法的计数结果由于A与C、B与D、E与G、F与H的取样量不一致,数据转换后,对A与C、B与D、E与G、F与H进行两两配对的t检验,结果A与C、B与D差异均无统计学意义(P>0.05),说明采用TSA培养基进行实验时,方法的选择对检测结果影响不大;E与G、F与H差异均有统计学意义(P<0.05),结合表1,说明采用R2A培养基平皿法检测结果较高。
2.2.6综合比较提供低营养环境的R2A培养基培养所得菌落数值高于TSA培养基,检出率较高。即:R2A培养基,30〜35V,120h,薄膜过滤法/平皿法,培养效果较好。同时,按《中国药典》2010年版的方法检测菌落数值较高,方法可行。
3、讨论
制药用水微生物检查法,《欧洲药典》采用低营养的R2A培养基培养条件有良好的促生长能力,有利于微生物的检出,但其菌落形态较小不利于计数,而且培养时间长;《美国药典》采用TSA培养基培养条件,在水样低污染时其促生长优势不明显,中等或较严重污染时,其促细菌生长能力较好,且菌落形态典型,易于观察计数;《中国药典》2010年版收载的方法可行,但是营养琼脂培养基上菌落形态不太典型,不如TSA培养基培养所得菌落计数明显。本次实验中玫瑰红钠琼脂培养基培养的菌落经确证均为细菌,且菌落数普遍少于营养琼脂培养基上所得菌落数,为避免重复计数,仅采用营养琼脂平皿上的菌落数分析统计。
《美国药典》、《欧洲药典》、《英国药典》、《中国药典》对制药用水的限度规定均为不得过100cfu•mL1,但由于培养基系统不同,是否能够真实地反映污染程度,提高方法的灵敏度非常重要。根据本次实验结果,低营养条件的R2A培养基,薄膜过滤法/平皿法,30〜35V,120h,有利于微生物的检出。
本研究参考国外药典及相关文献报道,TSA、R2A和营养琼脂培养基均选择培养温度30〜35V,高营养的TSA培养基培养时间为72h,低营养的R2A培养基培养时间为120h,延长培养时间有利于微生物的检出,故选择培养时间为120h,营养琼脂培养基依据枟中国药典》2010年版的规定时间培养。由于制药用水的污染情况未知,取样量为100mL时,可能会导致无法计数的问题,取样量为1mL时,可能由于取样量小,无法真实反映污染情况。可根据预估情况,取样量为1mL时,薄膜过滤法/平皿法均可行,取样量大于1mL时,宜采用薄膜过滤法。建议修订取样量为10mL,兼顾到取样的代表性和检测结果的可靠性。
在本研究中,采用《中国药典》2010年版方法进行的检测数值普遍较大,这可能是因为实验前充分考虑到选择污染较严重的水系统,而且不同培养基对不同细菌的选择性不同导致结果差异,这一问题需要进一步调查研究。
从微生物的危害性角度出发,在提高细菌数、霉菌及酵母菌数这些反映总体卫生情况的检查方法灵敏度的同时,更需关注其致病菌存在的可能。
The harmonisation of the ICH guideline Q4B Annex 4A onevaluation and recommendation of pharmacopoeial texts for use in the ICH regions on micro enumeration and tests for specified micro-organisms has also been completed with step 5. TheInternational Council for Harmonisation (ICH) has been working on theharmonisation of the requirements of the Pharmaocopoeias in the regions of theEU, the U.S. and Japan for several years already. Based on the evaluation bythe Q4B Expert Working Group (EWG), the ICH Steering Committee has recommendedthat the official pharmacopoeial texts on Microbial Enumeration,
微生物计数法和致病菌检验在ICH地区所用药典协调已达成第5阶段。ICH已经在欧盟、美国和日本药典要求统一方面工作数年。基于Q4B专家工作组(EWG)的评估,ICH专家委员声明以下官方药典内容:
Ph.Eur. 2.6.12. Microbiological Examination of Non-Sterile Products: Microbial Enumeration Tests,
欧洲药典2.6.12,非无菌药品微生物检验:微生物计数法
JP 4.05 Microbiological Examination of Non-Sterile Products: I. Microbiological Examination of Non-Sterile Products: Microbial Enumeration Tests, and
日本药典4.05 非无菌药品微生物检查:I、非无菌药品的微生物检查:微生物计数法,以及
USP <61> Microbiological Examination of Nonsterile Products
美国药典<61>非无菌药品的微生物检查
can be used interchangeably in the ICH regions.
可以在ICH地区互换使用。
Ph.Eur. 2.6.13. Microbiological Examination of Non-Sterile Products: Tests for Specified Micro-organisms,
欧洲药典2.6.13,无菌药品微生物检验:致病菌检验
JP 4.05 Microbiological Examination of Non-Sterile Products: II. Microbiological Examination of Non-Sterile Products: Tests for Specified Micro-organisms, and
日本药典4.05 非无菌药品微生物检验:II、非无菌药品的微生物检验:致病菌检验,以及
USP <62> Microbiological Examination of Nonsterile Products: Tests for Specified Microorganisms
美国药典<62>非无菌药品的微生物检验:致病菌检验
can be used as interchangeable in the ICH regions.
可以在ICH地区互换使用。
As always with ICH harmonisation processes, there is an addition stating that the FDA may request a demonstration that the chosenmethod is acceptable and suitable for a specific material or product,irrespective of its origin. The European Union states: "For the European Union, the monographs of the Ph. Eur. have mandatory applicability.Regulatory authorities can accept the reference in a marketing authorisation application, renewal or variation application citing the use of the corresponding text from another pharmacopoeia as referenced in Section 2.1, inaccordance with the conditions set out in this annex, as fulfilling therequirements for compliance with the Ph. Eur. Chapter 2.6.12. on the basis ofthe declaration of interchangeability made above.."
正如所有ICH协调流程一样,还有一附加声明:FDA可能需要证明所选的方法是可接受的,并且适合于特定物料或药品,而不管其处于何地区。欧洲则声明:“对于欧盟,欧洲药典的各论具有强制适用性。注册机构可以接受在上市许可申报、更新或变更申报中引用对另一药典的相应内容,即2.1部分的引用,基于上述互换声明,只要符合本附录中设定条件,满足欧洲药典2.6.12符合性要求即可。”

来源:Internet


