您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2019-06-02 18:00
2018年度医疗器械注册工作报告
2018年,国家药品监督管理局以习近平新时代中国特色社会主义思想为指导,按照“五位一体”总体布局和“四个全面”战略布局,以公众用械安全有效为目标,认真落实“四个最严”要求,按照《国务院关于改革药品医疗器械审评审批制度的意见》(国发〔2015〕44号)、中共中央办公厅国务院办公厅《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号),持续深化医疗器械审评审批制度改革,进一步加强对全国医疗器械注册工作监督和管理,不断提升医疗器械注册审评审批的质量与效率。
一、医疗器械注册工作情况
(一)医疗器械注册管理法规体系逐步完善
1.做好《医疗器械监督管理条例》(以下简称《条例》)及配套文件制修订工作。2018年6月25日,《条例》修订草案公开征求意见。对《医疗器械注册管理办法》《体外诊断试剂注册管理办法》以及注册申报资料要求等《条例》配套文件制修订进行研究。开展《定制式医疗器械监督管理规定(试行)》起草工作。
2.规范推进医疗器械技术审查指导原则制修订相关工作。发布《医疗器械注册技术审查指导原则制修订管理规范》,规范注册技术审查指导原则的制修订工作。发布《眼科超声诊断设备注册技术审查指导原则》等53项医疗器械技术审查指导原则,提升各级药品监管部门审查水平,统一审查尺度。
(二)医疗器械审评审批制度改革持续深入
1.优化临床试验审批,进一步明确临床评价、临床试验技术要求。发布《医疗器械临床试验设计指导原则》,提出临床试验设计技术要求。发布《接受医疗器械境外临床试验数据技术指导原则》,避免重复性临床试验,合理设置临床评价资料要求。发布《用于罕见病防治医疗器械注册审查指导原则》,规范该类医疗器械注册申报和审批工作,促进相应产品尽快进入市场。
2. 汇总修订免于进行临床试验医疗器械目录。对已发布的三批免于进行临床试验的医疗器械(含体外诊断试剂)目录进行修订和汇总,发布新修订免于进行临床试验医疗器械目录,对共计1254类产品免于进行临床试验。
3.优化医疗器械注册申报资料要求。发布《关于修改医疗器械延续注册等部分申报资料要求的公告》,简化企业延续注册申报资料,提高审查效率。简化多中心临床试验伦理审查要求,有利于多中心临床试验尽快开展。
4.继续做好创新医疗器械审批工作。2018年11月修订《创新医疗器械特别审查程序》。批准骨科手术机器人等21个创新医疗器械上市,降低临床治疗成本。依据《医疗器械优先审批工作程序》要求,对列入国家科技重大专项或者重点研发计划的、临床急需等医疗器械予以优先审批,批准风疹病毒IgG抗体检测试剂(荧光免疫层析法)等5个优先审批产品上市,满足临床急需。
5.推进医疗器械注册人制度试点工作。根据国务院全面深化自由贸易试验区改革开放方案的意见,在上海、广东、天津自贸区开展医疗器械注册人制度试点,为全国更大范围的实施医疗器械注册人制度积累经验,奠定实践基础。
6.落实“放管服”要求,推出“证照分离”相应改革措施。根据《国务院关于在全国推开“证照分离”改革的通知》,要求各省局在境内第二类医疗器械产品注册时压缩审批时限,出台鼓励措施,优化注册质量体系审查工作,精简审批材料。
(三)医疗器械注册基础工作不断夯实
1.开展医疗器械标准制修订工作。按照“十三五”国家药品安全规划要求,审核发布医疗器械行业标准104项,医疗器械国家标准10项。开展99项医疗器械行业标准的制修订,申报国家标准制修订项目6项,对监管急需、基础通用、战略性新兴产业标准予以优先立项。截至2018年底,我国现行有效医疗器械标准共1618项,其中国家标准219项、行业标准1399项。标准体系的覆盖面、系统性逐年提升,医疗器械标准与国际标准一致性程度已达90%以上。
2.继续做好医疗器械分类管理改革工作。开展新《医疗器械分类目录》宣贯培训,推动新分类目录平稳、有序实施。妥善处理产品类别转换问题,强化新《医疗器械分类目录》执行统一。
3.完善医疗器械命名管理工作。开展有源植入物、医学影像、口腔科医疗器械等领域第一批命名术语指南的起草工作。按照“十三五”国家药品安全规划要求,将无源手术器械、无源植入器械等领域列入第二批命名术语指南制定计划。
4.推动医疗器械唯一标识系统建设。研究制定医疗器械唯一标识系统总体思路和建设方案,起草《医疗器械唯一标识系统规则》,公开征求意见,形成送审稿。开展医疗器械唯一标识相关技术标准的制修订和信息化系统建设工作。
(四)临床试验监督管理不断加强
1.开展医疗器械临床试验监督检查。2018年6月和11月,开展2批医疗器械临床试验监督检查,对胶囊内窥镜系统等20个在审注册申请项目的临床试验数据真实性和合规性开展现场检查。发布《医疗器械临床试验检查要点和判定原则》。发布《冠状动脉药物洗脱支架临床前研究指导原则》等5项临床试验指导原则。
2.积极推动医疗器械临 床试验机构备案。截至2018年底,全国已有676家临床试验机构备案。
二、医疗器械注册申请受理情况
2018年,国家药品监督管理局依职责共受理医疗器械首次注册、延续注册和许可事项变更注册申请6608项,与2017年相比注册受理项目减少3.3%。
(一)整体情况
受理境内第三类医疗器械注册申请2382项,受理进口医疗器械注册申请4226项。
按注册品种区分,医疗器械注册申请4529项,体外诊断试剂注册申请2079项。
按注册形式区分,首次注册申请1657项,占全部医疗器械注册申请的25.1%;延续注册申请2806项,占全部医疗器械注册申请的42.5%;许可事项变更注册申请2145项,占全部医疗器械注册申请的32.5%。注册形式比例情况见图1。
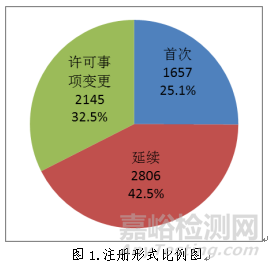
(二)分项情况
1.境内第三类医疗器械注册受理情况
境内第三类医疗器械注册受理共2382项,与2017年相比减少3.1%。其中,医疗器械注册申请1565项,体外诊断试剂注册申请817项。
从注册形式看,首次注册975项,占全部境内第三类医疗器械注册申请数量的41.0%;延续注册799项,占全部境内第三类医疗器械注册申请数量的33.5%;许可事项变更608项,占全部境内第三类医疗器械注册申请数量的25.5%。注册形式分布情况见图2。
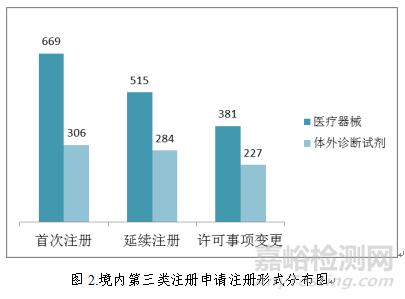
2.进口第二类医疗器械注册受理情况
进口第二类医疗器械注册受理共2125项,与2017年相比增加3.3%。其中医疗器械注册申请1144项,体外诊断试剂注册申请981项。
从注册形式看,首次注册388项,占全部进口第二类医疗器械注册申请数量的18.3%;延续注册1001项,占全部进口第二类医疗器械注册申请数量的47.1%;许可事项变更736项,占全部进口第二类医疗器械注册申请数量的34.6%。注册形式分布情况见图3。
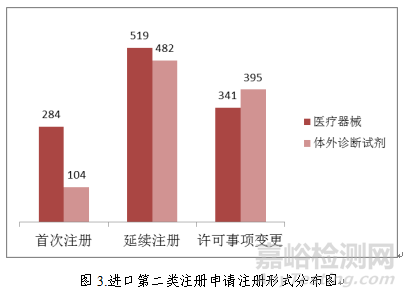
3.进口第三类医疗器械注册受理情况
进口第三类医疗器械注册受理共2101项,与2017年相比减少9.4%。其中医疗器械注册申请1820项,体外诊断试剂注册申请281项。
从注册形式看,首次注册294项,占全部进口第三类医疗器械注册申请数量的14.0%;延续注册1006项,占全部进口第三类医疗器械注册申请数量的47.9%;许可事项变更801项,占全部进口第三类医疗器械注册申请数量的38.1%。注册形式分布情况见图4。
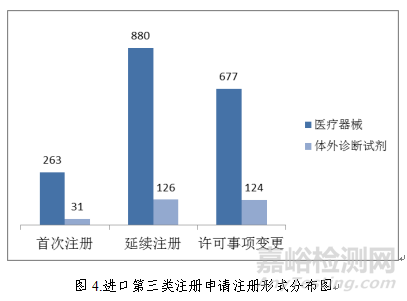
三、医疗器械注册审批情况
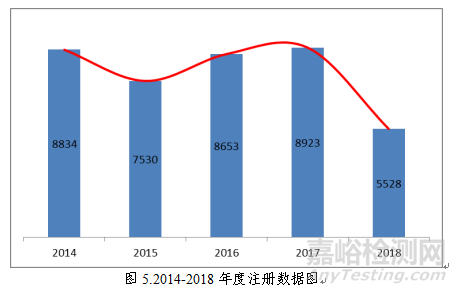
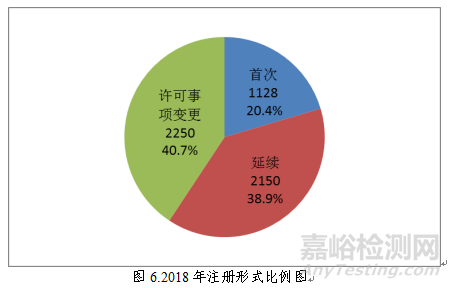
2018年,国家药品监督管理局共批准医疗器械首次注册、延续注册和变更注册5528项。与2017年相比注册批准总数量减少38.0%。其中,首次注册 1128项,延续注册2150项,许可事项变更2250项。
2018年,国家药品监督管理局共对118项医疗器械注册申请不予注册,企业自行撤回238项。
近五年国家药品监督管理局批准医疗器械注册情况见图5。
(一)整体情况
2018年,国家药品监督管理局批准境内第三类医疗器械注册1709项,与2017年相比减少48.2%,进口医疗器械3819项,与2017年相比减少32.1%。
按照注册品种区分,医疗器械3734项,占全部医疗器械注册数量的67.5%;体外诊断试剂1794项,占全部医疗器械注册数量的32.5%。
按照注册形式区分,首次注册1128项,占全部医疗器械注册数量的20.4%;延续注册2150项,占全部医疗器械注册数量的38.9%;许可事项变更注册2250项,占全部医疗器械注册数量的40.7%。注册形式比例情况见图6。
(二)分项情况
1.境内第三类医疗器械注册审批情况
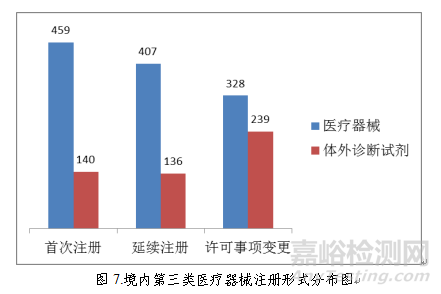
境内第三类医疗器械注册1709项。其中,医疗器械1194项,体外诊断试剂515项。
从注册形式看,首次注册599项,占全部境内第三类医疗器械注册数量的35.0%,延续注册543项,占全部境内第三类医疗器械注册数量的31.8%;许可事项变更注册567项,占全部境内第三类医疗器械注册数量的33.2%。注册形式分布情况见图7。
2.进口第二类医疗器械注册审批情况
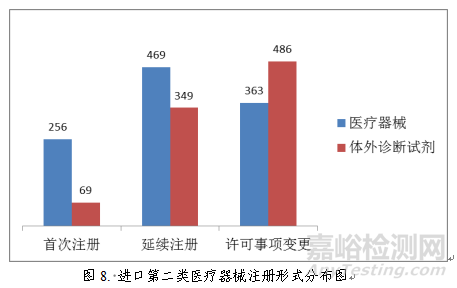
进口第二类医疗器械注册1992项。其中,医疗器械注册1088项,体外诊断试剂注册904项。
从注册形式看,首次注册325项,占全部进口第二类医疗器械注册数量的16.3%;延续注册818项,占全部进口第二类医疗器械注册数量的41.1%;许可事项变更注册849项,占全部进口第二类医疗器械注册数量的42.6%。注册形式分布情况见图8。
3.进口第三类医疗器械注册审批情况
进口第三类医疗器械注册1827项。其中,医疗器械注册1452项,体外诊断试剂注册375项。
从注册形式看,首次注册204项,占全部进口第三类医疗器械注册数量的11.2%;延续注册789项,占全部进口第三类医疗器械注册数量的43.2%;许可事项变更注册834项,占全部进口第三类医疗器械注册数量的45.6%。注册形式分布情况见图9。
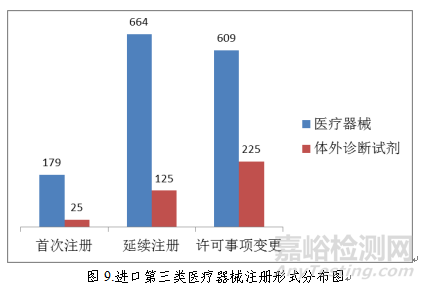
(三)首次注册项目月度审批情况
2018年,国家药品监督管理局共批准医疗器械首次注册1128项,月度审批情况见图10。
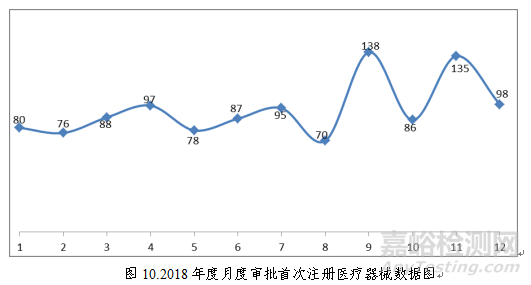
(四)具体批准品种种类分析
2018年8月1日新版《医疗器械分类目录》实施以后,注册的境内第三类医疗器械,除体外诊断试剂外,共涉及《医疗器械分类目录》中17个子目录的产品。
注册数量前五位的境内第三类医疗器械是:无源植入器械,注输、护理和防护器械,医用成像器械,患者承载器械,神经和心血管手术器械。
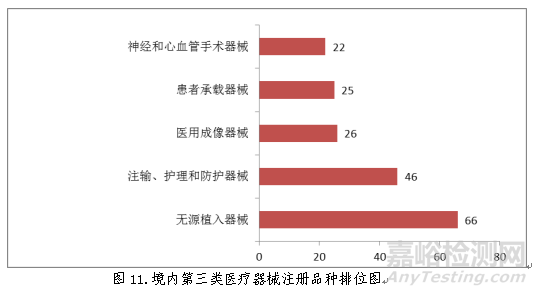
2018年8月1日新版《医疗器械分类目录》实施以后,注册的进口医疗器械,除体外诊断试剂外,共涉及《医疗器械分类目录》中19个子目录的产品。
注册数量前五位的进口医疗器械,主要是:医用成像器械,临床检验器械,无源植入器械,医用诊察和监护器械,口腔科器械。
(五)进口医疗器械国别情况
2018年,美国、德国、日本、韩国和瑞士医疗器械在中国医疗器械进口产品首次注册数量排前五位,注册产品数量约占2018年进口产品首次注册总数量的75.6%,与2017年相比略有增加。
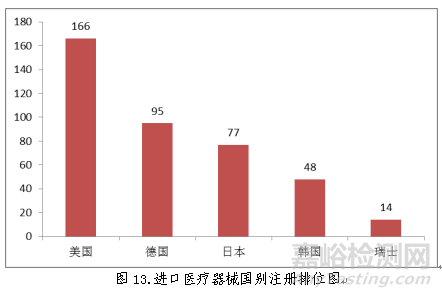
(六)境内第三类医疗器械省份分析
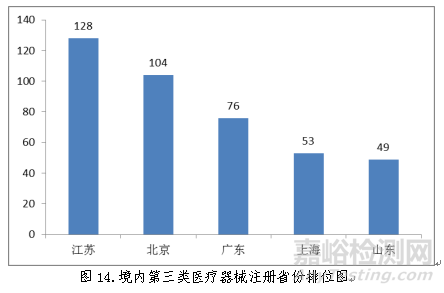
从2018年境内第三类医疗器械注册情况看,相关注册产品生产企业主要集中在沿海经济较发达省份。其中,北京、江苏、广东、上海、浙江是境内第三类医疗器械首次注册数量排前五名的省份,占2018年境内第三类医疗器械首次注册数量的68.4%,与2017年相比略有增加。
四、创新医疗器械等产品注册审批情况
2018年,国家药品监督管理局按照《创新医疗器械特别审查程序》,继续做好创新医疗器械审查工作,并批准了部分创新医疗器械产品上市。
2018年,国家药品监督管理局共收到创新医疗器械特别审批申请316项,完成310项审查(含2017年申请事项),确定45个产品进入创新医疗器械特别审批通道。批准21项创新医疗器械产品上市。其中,有源医疗器械7项,无源医疗器械5项,体外诊断试剂9项,与2017相比总数增加8项。
这些创新产品核心技术都有我国的发明专利权或者发明专利申请已经国务院专利行政部门公开,产品主要工作原理/作用机理为国内首创,具有显著的临床应用价值。以下是一些具有代表性的创新医疗器械产品介绍:
(一)人类EGFR基因突变检测试剂盒(多重荧光PCR法)(国械注准20183400014,厦门艾德生物医药科技股份有限公司)。该产品基于自主创新的高度灵敏的PCR专利技术,用于体外定性检测晚期非小细胞肺癌(NSCLC)患者血浆DNA样本中人类EGFR突变基因。该产品是我国首个批准用于甲磺酸奥希替尼片的伴随诊断检测产品,在临床上为医生制定个体化治疗方案提供参考。
(二)可吸收硬脑膜封合医用胶(国械注准20183650031,山东赛克赛斯药业科技有限公司)。该产品适用于开颅手术中硬脑膜缝合部位的辅助封合,能够有效防止脑脊液渗漏。脑脊液渗漏的治疗是一项复杂而棘手的难题,目前对硬脑膜损伤的修补主要有直接缝合修补法、自体组织修补法、人工合成材料修补法等。相较于常规修补法,该产品的创新之处在于将其喷涂到手术部位后,会迅速聚合形成具有空间立体网状结构的黏性水凝胶,对手术缝合后仍存在的硬脑膜脊液渗漏起到辅助封合作用。其临床使用为开颅手术中硬脑膜缝合后的脑脊液渗漏的封堵提供了一种新的解决方案。
(三)血管重建装置(国械注准20183770102,微创神通医疗科技(上海)有限公司)。该产品适用于颈内动脉及椎动脉未破裂囊性动脉瘤的患者。大及巨大型宽颈动脉瘤的治疗是目前临床面临的一大难题。该产品通过低孔率的支架和高金属覆盖率的结构设计改变了动脉瘤的血流动力学,进而诱发动脉瘤内血栓形成,促进瘤颈部的内膜增生,达到治疗颅内动脉瘤的目的,同时输送导丝上的输送膜设计实现了支架的回收及重新定位,降低了手术过程中的操作风险。该产品临床使用为大及巨大型宽颈动脉瘤的治疗提供了新的治疗策略。
(四)miR-92a检测试剂盒(荧光RT-PCR法)(国械注准20183400108,深圳市晋百慧生物有限公司)。该产品采用RNA提取试剂盒提取粪便中的RNA,进行RT-PCR反应。miR-92a对于大肠癌的辅助检测是一个新的标志物,且得到了较为广泛的认可,产品样本采集方便,不会对患者造成痛苦及不适,于大肠癌的辅助诊断提供了一种较为方便的方法,可以较快的提供检测结果以指导医生对患者的诊治,对于高危人群同时由于不同原因拒绝进行肠镜检查患者的大肠癌临床辅助诊断具有较高的应用价值。
(五)丙型肝炎病毒核酸测定试剂盒(PCR-荧光探针法)(国械注准20183400157,北京纳捷诊断试剂有限公司)。该产品基于自主创新的一管法的PCR专利技术,用于体外定量测定血清样本中的丙型肝炎病毒(HCV)核酸(RNA)。该产品适用于需要进行HCV感染检测的患者和接受抗病毒治疗的丙型肝炎患者。
(六)脑血栓取出装置(国械注准20183770186,江苏尼科医疗器械有限公司)。该产品适用于不能使用静脉组织型纤溶酶原激活物(IV t-PA)或使用IV t-PA治疗失败的患者,预期用于在症状发作8小时内移除缺血性脑卒中患者颅内大血管中的血栓,从而恢复血流。该产品由支架型取栓网、推送金属丝和不透射线显影标记组成。该产品优化了取栓网宽窄度和单元格结构,提高了径向支撑力,同时取栓网具有环状单元格及锥形过渡结构设计,提高推送性能;采用物理和化学方法对取栓网近端、推送金属丝、显影圈的三者连接处进行紧固措施,提高了脑血栓取出装置的连接强度。临床试验证明,机械取栓治疗能够明显改善大血管闭塞患者预后,降低致残和死亡率,该产品的上市为患者提供了更多选择。
(七)定量血流分数测量系统(国械注准20183210282,博动医学影像科技(上海)有限公司)。该产品可基于冠状动脉血管造影的影像定量计算获得定量血流分数(QFR, Quantitative Flow Ratio),预期供培训合格的医技人员用于成人患者冠状动脉病变血管的功能学评价,反映临床当前情况下心肌灌注/缺血程度,帮助临床医生识别冠状动脉的病变,帮助临床医生评估冠状动脉狭窄是否导致冠状动脉下游心肌供血的缺血。临床中还应结合患者的临床病史、症状、其他诊断结果和临床医生的专业判断来综合评价冠状动脉血管。该产品可无创地获得定量血流分数,基于流体力学计算分析,利用冠状动脉造影三维重建的结果和平均血流速度,计算血管每个位置与最近端位置的压力差,求解出目标血管每一个位置的定量血流分数。该产品的临床优势主要有:QFR分析的一致性非劣效于临床金标准,诊断性能优效于临床常规方法,无额外创伤,不诱发斑块破裂,不损伤血管,不使用微循环扩张药,使用中不受患者病变的限制,测量时间短。
(八)复合疝修补补片(国械注准20183130292,上海松力生物技术有限公司)。该产品适用于开放性腹腔外修补腹股沟疝。该产品以L-丙交酯、己内酯的共聚物与猪源纤维蛋白原的共混物为原料,采用静电纺技术制成的复合补片。产品具有微孔支架结构,人体组织在支架内部生长并修补缺损,支架材料可降解。产品还具有比表面积大和亲水性的特点,有助于患者自体创伤愈合相关因子和细胞的粘附。
(九)正电子发射断层扫描及磁共振成像系统(国械注准20183060337,上海联影医疗科技有限公司)。该产品包括PET(正电子发射断层扫描)及MR(磁共振)两部分,实现了PET成像及MR成像的一体化结合,可实现同步且等中心采集生理、解剖和生化代谢信息,并将这些信息配准和融合。PET/MR成像集合了PET和MR两种成像模式的优势,具有多模态、多对比度、高分辨率、高灵敏度和低辐射剂量等优点。临床实践已经证明了其在头颈部肿瘤、腹部肿瘤、退行性神经病变、全身淋巴瘤等疾病诊断中,相比其他成像方式具有显著优势。
(十)植入式迷走神经刺激脉冲发生器套件和植入式迷走神经刺激电极导线套件(国械注准20183120409、国械注准20183120410,北京品驰医疗设备有限公司)。植入式迷走神经刺激脉冲发生器套件由脉冲发生器、测试电阻、力矩螺丝刀和控制磁铁组成。植入式迷走神经刺激电极导线套件由电极、造隧道工具(包括穿刺工具和套管)和固定夹组成。上述两个产品配合使用,对药物不能有效控制的难治性癫痫患者能起到控制癫痫发作的作用,是迷走神经刺激治疗癫痫病的首例国产产品。
(十一)瓣膜成形环(国械注准20183130534,金仕生物科技(常熟)有限公司)。该产品用于纠正和重塑病变的瓣环,维持合理的瓣叶对合面积,适用于二尖瓣/三尖瓣心脏瓣环修复手术需要使用人工瓣膜成形环的患者。瓣膜修复是治疗心脏瓣膜疾病的重要方法之一。该产品采用三维双鞍及变螺距双螺旋结构设计,变螺距双螺旋渐变设计使前环和后环具有不同硬度,预期更符合瓣环的生理结构并优化瓣叶应力分布。该产品上市为患者提供了更多选择。
五、其他注册管理情况
(一)境内第二类医疗器械注册审批情况
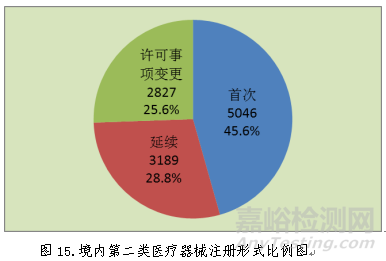
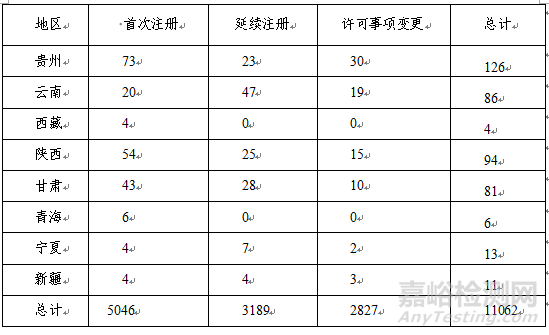
2018年,各省级药品监管部门共批准境内第二类医疗器械注册11062项,与2017年相比减少40.5%。其中首次注册5046项,占全部境内第二类医疗器械注册数量的45.6%;延续注册3189项,占全部境内第二类医疗器械注册数量的28.8%;许可事项变更注册2827项,占全部境内第二类医疗器械注册数量的25.6%。境内第二类医疗器械分项注册情况见图15。
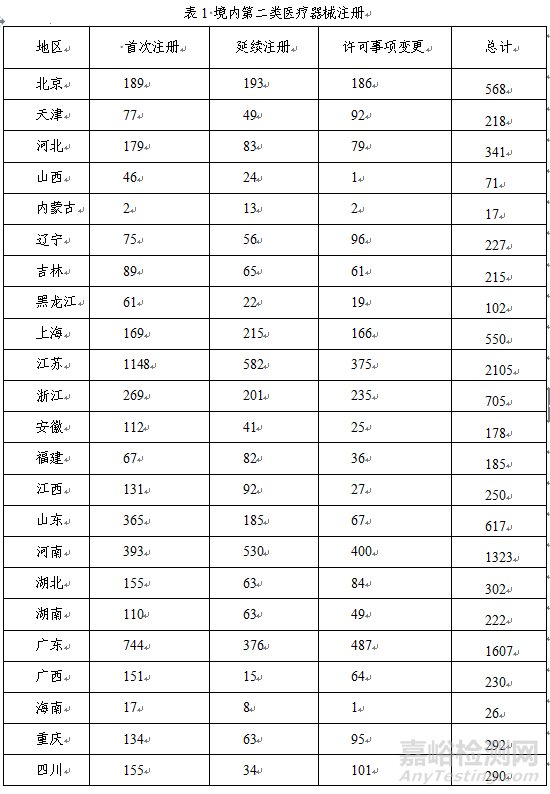
从注册情况看,江苏、广东、河南、浙江、山东、北京、上海七省(直辖市)注册的境内第二类医疗器械数量较多。第二类医疗器械注册具体数据见表1及图16。
(二)第一类医疗器械备案情况
2018年,国家药品监督管理局依职责共办理进口第一类医疗器械备案数量1744项,与2017年相比减少24.7%。全国设区的市级药品监管部门依职责共办理境内第一类医疗器械备案数量17177项,与2017年相比增长30.1%。
(三)登记事项变更情况
2018年,国家药品监督管理局依职责共办理进口第二、三类和境内第三类医疗器械登记事项变更7661项。与2017年相比增加47.9%。
其中,境内第三类医疗器械登记事项变更1598项,进口第二类、三类医疗器械登记事项变更6063项。
各省级药品监管部门依职责共办理境内第二类医疗器械登记事项变更6354项,与2017年相比增加0.4%。
注:本报告的数据统计自2018年1月1日至2018年12月31日。

来源:国家药监局


