您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2019-01-29 09:39
医疗器械第二、三类器械在注册上市前,根据相关法律法规要求,需要进行临床评价以评估该医疗器械的安全有效性。而在器械产品注册临床阶段中,或多或少都会遇到一些问题。现就我们就一些器械产品注册临床阶段会遇到的部分问题进行一些相关探讨。
1注册单元划分问题
在进行产品申报注册前,我们首先要明确注册单元划分问题,因为注册单元划分直接关系到产品能否一同申报以及后续临床试验设计的合理性。目前按照相关法规,对于产品多数从产品固定方式、机理、材料组成等进行相关注册单元划分。
1.1按照产品自身机理划分:即按照产品自己工作机理进行相关划分,例如在骨科髓内钉器械的划分可以按照其固定机理进行划分。髓内钉器械按照固定机理划分下,分为带锁髓内钉和不带锁髓内钉;从临床角度出发,这种划分是合理的,因为带锁髓内钉和不带锁髓内钉在适用范围和功能上是区别很大的。譬如,在适用范围方面,不带锁髓内钉中既往应用较广的是梅花针,梅花针的主要适应证是股骨中上1/3骨折,而带锁髓内钉可应用于股骨干骨折、胫骨干骨折、肱骨干骨折等;在功能方面,梅花针因为没有带锁固定,因此无法对抗骨折的旋转,且固定相对不稳定,容易出现退针等情形。此类产品,虽然都是髓内钉,但是需要划分成不同的注册单元,因为其工作机理不一样。
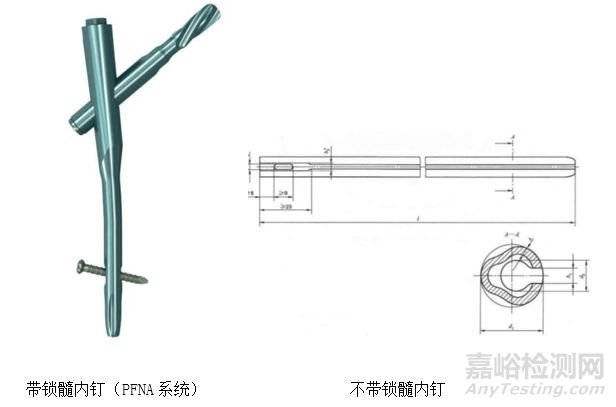
(图片来源自互联网)
1.2. 按照产品固定方式划分:某些医疗器械需要进行相关固定才可发挥其作用,因此可按照产品固定方式进行相关划分。例如对于人工髋关节假体系统而言,因固定方式不同,可划分为骨水泥型髋关节假体和非骨水泥型关节假体。从临床角度出发,之所以这么划分,是因为这两种髋关节假体工作机理虽然大致一样,但是其固定方式的不同。而这种固定方式的不同,直接和临床疗效紧密相关。骨水泥型假体柄在固定时,是在骨水泥泥团样未固化期时,填入假体和骨的缝隙中,固化后骨水泥起到空间充填镶嵌作用而固定假体,同时起到载荷应力传递;而非骨水泥型假体柄在固定时,初始依靠的是机械卡压力量维持稳定,后期固定依靠的是骨长入假体中表面涂层的多孔表面起到固定作用;两种固定方式的不同,也决定了相关预后情况;因此虽然其均是髋关节假体系统,但是仍需按照不同的注册单元进行相关划分。

髋关节假体系统(图片来源自互联网)
1.3. 按照材料组成方式划分:即按照组成材料不同进行相关注册单元划分。例如,就带线锚钉而言,锚钉的组成材料(包括材料牌号)不同,应分为不同的注册单元;其配合使用的缝线组成材料不同,也应分为不同的注册单元。从临床角度出发,最主要的原因就在于,不同材料组成的锚钉,其强度不同,耐久度不同;而不同材料组成的缝线,也有可吸收和不可吸收的区别,而可吸收材料里面也有吸收快慢的区别。这些区别将会直接影响到最终的临床疗效。譬如修复需要承担较强力量且生长较慢的组织,却采用了较短时间可吸收的带线锚钉,将有可能出修复失效、再次手术等相关风险。因此,虽然都称之为带线锚钉,仍需要按照不同的材料组成进行相关注册单元的划分。
带线锚钉(图片来源自互联网)
当然,最终某医疗器械按照何种注册单元进行划分,还是需要具体到某一种或某一类器械。
2临床试验单元划分问题
部分器械,即使是同一注册单元下的产品,在临床试验设计阶段,也可能需要分为不同的临床试验单元进行相关临床试验设计。例如,同样是一个注册单元的骨水泥型髋关节假体,但是仍需要根据预期申报的适用范围不同(初次置换、假体翻修、肿瘤关节置换),划分为不同的临床试验单元进行试验。从临床角度出发,其主要原因在于适用范围不同,其面对的情形完全不同。譬如初次髋关节置换和翻修型髋关节置换,其手术难度和创伤程度完全不同。初次髋关节假体置换,手术入路解剖清晰,几乎不存在骨缺损、假体难以取出等相关问题;而翻修则面临着手术入路解剖不清晰,髋臼侧骨缺损,假体难以取出,大量截骨后肌肉止点无处附着等一系列情形,相关手术创伤、手术时间、出血量及术后康复情形完全不同。其次,两者器械的基本结构和组成也不一样,因为是根据不同情形进行的相关设计。例如,相对于初次置换的髋关节假体而言,翻修型假体往往具有更长的股骨柄和更为灵活放置的髋臼侧假体;而此类器械的区别也会导致在手术使用过程中的差异。因此,虽然均是骨水泥型髋关节假体系统,两者仍需要进行临床试验单元划分后,再进行相关临床试验。
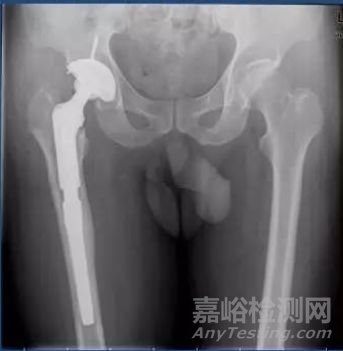
翻修型髋关节假体系统术后(图片来源自互联网)
3主要评价指标的选取问题
主要评价指标的选取也是临床试验设计阶段常常会遇到的问题,那么一般而言,如何进行主要评价指标的选取呢?
A. 对于有相关《指导原则》的器械产品,建议采用《指导原则》产品的主要评价指标;如《金属接骨板内固定系统产品注册技术审查指导原则》中规定:主要评价指标以“产品有效率”为主要评价指标,将“产品有效”定义为同时满足以下要求(a)骨折愈合评价标准:局部无压痛及纵向叩击痛,局部无异常活动;术后24周骨折部位正侧位X线片上骨折间隙模糊或消失,或者正侧位X线片上可见连续性骨痂越过骨折线;(b)术后24周受试产品无变形或断裂。此时,我们采用“产品有效率”作为主要评价指标。
B. 对于没有相关《指导原则》的器械产品,但是其相类似产品有《指导原则》,那么也可以参考类似产品的《指导原则》。譬如对于交锁髓内钉内固定系统的产品,其工作机理虽然与金属接骨板不同,但是在临床上,均是运用于骨折固定的,其适应证基本相同,那么此时,可以借鉴参考《金属接骨板内固定系统产品注册技术审查指导原则》,以“产品有效率”为主要评价指标。
C. 对于没有相关《指导原则》的器械产品,相类似的产品也没有相关《指导原则》或者《指导原则》中未明确主要评价指标时,我们就需要根据临床实际,结合器械本身特征,并结合试验目的,进行主要评价指标的选取。
4随访周期问题
临床试验设计随访周期往往也是需要考虑的重点。对于同样是接骨板,金属接骨板和可吸收接骨板的随访周期存在不同。金属接骨板根据《金属接骨板内固定系统产品注册技术审查指导原则》中规定:应随访至骨折的临床愈合,至少为6个月。那么随访周期最少可设置为6个月。但是对于可吸收型接骨板,6个月时间不一定足够,其随访周期除却考虑骨折愈合时间外,还需要考虑其本身的降解时间,随访持续时间或者长于产品的降解时间,或者直至产品植入后的组织反应达到稳定状态;譬如某可吸收接骨板完全降解时间为8个月,那么临床试验的随访周期则至少为8个月,随访周期必须涵盖完全降解时间。
以上四点是器械产品注册临床阶段常见的几点问题,我们对于此几点问题进行了相关的探讨,当然落实到具体相关医疗器械,也需要具体问题具体分析,不可以偏概全。以上如若存在错误的地方,欢迎批评指正。

来源:奥咨达


