适用范围
您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2018-05-09 10:30
随着计算机技术的快速发展,医疗器械软件的种类日渐增多,在医疗器械中所起的作用越来越强,开发方式灵活多样,但随之带来的质量问题也越来越突出,造成的召回事件日益增加,严重性不容忽视。
美国FDA自1983年至2005年的医疗器械软件召回数据如表1所示:
表1:FDA医疗器械软件召回数据
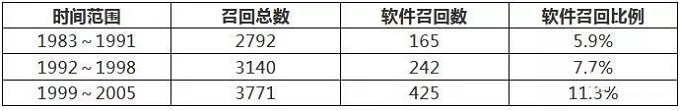
注:本表数据源自FDA的软件召回分析文献和软件指南。
表1数据表明软件召回的增速高于医疗器械整体情况,这说明医疗器械软件的质量问题日益突出。1999~2005的召回数据还表明内含软件的医疗器械召回有33.7%与软件失效有关,这说明软件失效是导致内含软件医疗器械召回的重要原因。1992~1998的召回数据还表明软件召回有79.3%与软件变更有关,这说明软件变更是导致医疗器械软件召回的主要原因。
同时,FDA的I级召回(导致死亡或严重伤害)数据表明:2007年有5例医疗器械因软件失效而I级召回,2009年有3例医疗器械因软件失效而I级召回,这说明医疗器械软件失效足以致命或造成严重伤害。因此,医疗器械软件的质量问题不容忽视,急需加强监管力度。
为了进一步保障人民群众的用械安全和提高技术审评的质量,结合YY/T 0664-2008 《医疗器械软件 软件生存周期过程》、YY/T 0708-2009 《医用电气设备 第1-4部分:安全通用要求 并列标准 可编程医用电气系统》和GB/T 25000.51-2010《软件工程 软件产品质量要求与评价(SQuaRE) 商业现货(COTS)软件产品的质量要求与测试细则》等相关标准的要求,我中心在2011年先后开展了欧美软件监管的文献调研、软件生产企业的实地考察、软件技术审评专家研讨会等工作,在上述工作的基础上提出了医疗器械软件注册申报的基本要求,现说明如下:
适用范围
本文件适用的医疗器械产品注册类型包括境外产品首次注册与重新注册、境内III类产品首次注册与重新注册,适用的开发方式包括自主开发、部分采用现成软件和全部采用现成软件。具体包括:
1、独立软件:本身是医疗器械或附件的软件,如处理型软件、数据型软件;
2、软件组件:作为医疗器械、部件或附件组成部分的软件,如嵌入式软件、控制型软件;
3、专用软件:其他有特定用途的软件,如个体化定制型软件。
申报要求
制造商应提供一份单独的医疗器械软件描述文档,包括基本信息、实现过程和核心算法三部分内容,详尽程度取决于医疗器械软件的安全性级别和复杂程度。软件安全性级别(YY/T 0664-2008)基于医疗器械软件损害严重度分为:
A级:不可能对健康有伤害和损坏;
B级:可能有不严重的伤害;
C级:可能死亡或严重伤害。
对于B级和C级的医疗器械软件,软件描述文档的部分内容应提供原始文件。表2是医疗器械软件描述文档的总体要求:
表2:医疗器械软件描述文档申报要求
|
描述文档 |
A级(轻微) |
B级(中等) |
C级(严重) |
|
|
基本信息 |
产品标识 |
描述软件名称、型号、版本号、制造商和生产地址 |
||
|
安全性级别 |
描述软件安全性级别,并详述安全性级别确定理由 |
|||
|
结构功能 |
依据体系结构图,描述软件的组成模块、模块功能、模块关系、外部接口和用户界面 |
|||
|
硬件关系 |
依据物理拓扑图,描述软件、通用计算机和医疗器械硬件的物理连接关系 |
|||
|
运行环境 |
描述软件运行所需的硬件配置、软件环境和网络条件 |
|||
|
适应范围 |
描述软件的适用范围和适用人群 |
|||
|
禁忌症 |
描述软件的禁忌症和不适用人群 |
|||
|
上市历史 |
描述软件在中国、原产国等主要国家地区的上市时间、版本号和管理类别 |
|||
|
实现过程 |
开发综述 |
描述开发语言、工具、方法、模型、人员、时间、工作量、代码行数和控制文档数 |
||
|
风险管理 |
提供风险管理资料 |
|||
|
需求规格 |
需求规格的功能、性能要求 |
需求规格全文,包含硬件、功能、性能、输入输出、接口界面、警示信息、保密安全、数据与数据库、文档和法规的要求 |
||
|
生存周期 |
开发生存周期计划摘要 |
开发生存周期计划、配置管理计划和维护计划的摘要 |
开发生存周期计划、配置管理计划和维护计划的摘要,列明各阶段输入输出文档 |
|
|
验证与确认 |
系统测试和用户测试的计划与报告摘要 |
概述开发各阶段的验证活动,提供系统测试和用户测试的计划与报告摘要 |
概述开发各阶段的验证活动,提供系统测试和用户测试的计划与报告 |
|
|
缺陷管理 |
描述缺陷总数和剩余缺陷数 |
描述缺陷总数和剩余缺陷数,列明剩余缺陷的严重度、处理措施和处理时间 |
||
|
修订历史 |
描述版本号命名规则,列明本次修订的版本号、类型和日期 |
描述版本号命名规则,列明本次修订的版本号、类型和日期,详述本版与前版的变更内容 |
描述版本号命名规则,列明本次和以往修订的版本号、类型和日期,详述本版与前版的变更内容 |
|
|
临床评价 |
提供临床评价资料 |
|||
|
核心算法 |
公认成熟算法列明名称,全新算法列明名称、原理和用途 |
公认成熟算法列明名称、原理和用途,全新算法除列明名称、原理和用途外,还应提供安全性与有效性的验证资料 |
||
|
附:部分现成软件 |
在结构功能、风险管理、验证与确认中有相应要求 |
在结构功能、需求规格、风险管理、生存周期、验证与确认和缺陷管理中有相应要求 |
||
医疗器械软件描述文档的具体内容要求如下:
1
基本信息
1.1 产品标识
描述医疗器械软件的名称、型号、版本号、制造商和生产地址,软件组件为内部标识。
1.2 安全性级别
依据软件的功能、预期用途和使用环境说明医疗器械软件的安全性级别,并详细说明安全性级别的确定理由。
1.3 结构功能
依据软件设计规格(SDS)给出体系结构图,图示医疗器械软件组成模块之间、组成模块与外部接口之间的关系。依据体系结构图描述组成模块的功能、模块关系、模块与外部接口关系以及用户界面。组成模块应注明选装、版本号及现成软件的名称、版本号、制造商和类型(外包、成品、遗留)。
1.4 硬件关系
依据软件设计规格(SDS)给出物理拓扑图,图示医疗器械软件、通用计算机、医疗器械硬件相互之间的物理连接关系。依据物理拓扑图描述医疗器械软件(或组成模块)与通用计算机、医疗器械硬件的物理连接关系。
1.5 运行环境
描述医疗器械软件运行所需的硬件配置、软件环境和网络条件。硬件配置包括包括处理器、存储器、外设器件和IO设备,软件环境包括系统软件、支持软件、必备软件、选配软件和杀毒软件,网络条件包括网络接口、网络类型(局域网、广域网)和网络架构(CS、BS)。
1.6 适用范围
独立软件应描述软件的适用范围和适用人群,软件组件应描述其整体的功能用途以及医疗器械产品的适用范围和适用人群。
1.7 禁忌症
独立软件应描述软件的禁忌症和不适用人群,软件组件应描述其整体的禁用功能以及医疗器械产品的禁忌症和不适用人群。
1.8 上市历史
医疗器械软件在中国实质首次注册应依据《医疗器械分类目录》及后续分类界定通知说明软件的管理类别,实质重新注册应列明在中国所有已上市产品的版本号和产品注册证号。
同时应列明医疗器械软件在原产国、美国、日本和欧盟等主要国家与地区首次上市的时间、版本号和管理类别。软件组件应描述医疗器械产品(包含本软件组件)的上市历史。
2
实现过程
2.1 开发综述
描述医疗器械软件开发过程所用的语言、工具、方法和生存周期模型,其中工具应描述支持软件(含开源软件)和应用软件(第三方软件)的名称、版本号和制造商。同时应说明开发人员数量、开发时间、工作量(人月数)、代码行总数和控制文档总数。
2.2 风险管理
应提供风险管理报告,包括名称、严重度、原因、解决措施和结果。
风险管理实施情况应另附原始文件,软件组件应提供医疗器械的风险管理报告。当组成模块采用现成软件时,所有级别医疗器械软件均应对现成软件进行风险管理。
2.3 需求规格
A级医疗器械软件应描述软件需求规格(SRS)关于功能和性能的要求。B级和C级医疗器械软件应提供软件需求规格全文。
需求规格应另附原始文件,软件组件可提供医疗器械产品的需求规格。当组成模块采用现成软件时,B级和C级医疗器械软件应说明相应要求。
2.4 生存周期
A级医疗器械软件应提供软件开发生存周期计划摘要,描述各阶段的任务、内容和结果。B级医疗器械软件在A级基础上应提供软件配置管理计划摘要和维护计划摘要,描述相应的工具、流程和要求。C级医疗器械软件在B级基础上应列明各阶段的输入输出控制文档。
生存周期实施情况应另附原始文件,YY/T 0664-2008或YY/T 0708-2009核查表可提供作为参考。当组成模块采用现成软件时,B级和C级医疗器械软件应在开发生存周期计划、配置管理计划和维护计划中说明相应要求。
2.5 验证与确认
A级医疗器械软件应提供系统测试、用户测试的测试计划和报告摘要,描述测试的条件、工具、方法、通过准则和结果。B级医疗器械软件在A级基础上应概要介绍开发各阶段的验证活动,描述相应的工具、方法、内容和结果,其中单元测试应描述覆盖率要求,集成测试应描述集成策略。C级医疗器械软件应概要介绍开发各个阶段的验证活动,并提供系统测试、用户测试的测试计划和报告。
系统测试和用户测试应另附原始文件,可追溯性分析报告可提供作为参考。当组成模块采用现成软件时,所有级别软件均应进行验证与确认。
2.6 缺陷管理
A级医疗器械软件应描述缺陷管理的工具、流程和要求,列明开发阶段所发现的缺陷总数和剩余缺陷数。B级和C级医疗器械软件在A级的基础上应列明剩余缺陷的严重度、处理措施和处理时间。
当组成模块采用现成软件时,B级和C级医疗器械软件应列明全部剩余缺陷情况。
2.7 修订历史
A级医疗器械软件应描述软件版本号的命名规则,列明软件在原产国本版本所有修订活动的版本号、类型(完善型、适应型、纠正型)和日期。B级医疗器械软件在A级基础上应详述本版本与原产国前次批准上市版本的变更内容。C级医疗器械软件在B级基础上应列明软件在原产国首次上市后历次修订且批准上市的版本号、类型和日期。
2.8 临床评价
临床评价资料包括文献资料、临床数据和临床试验报告,应另附原始文件。
3
核心算法
依据软件设计规格(SDS)和用户说明书列明核心算法的名称、原理、用途和类型。核心算法包括后处理算法和人工智能算法,其中后处理算法通常会改变原始医学图像或数据,包括但不限于压缩、分割、配准融合、三维重建、量化分析和异常识别;人工智能算法通常基于数据库进行分析处理,包括但不限于模式识别、神经网络和专家系统。类型是指公认成熟算法(公开文献专利标准、原理简单明确、上市超过四年且无不良事件)或全新算法(源自科学研究和临床数据)。
核心算法提交材料的详尽程度取决于安全性级别和类型。当安全性级别为A级时,公认成熟算法可只列明名称,全新算法应描述原理和用途。当安全性级别为B级或C级时,公认成熟算法应描述原理和用途,全新算法除描述原理和用途外还应提供安全性与有效性的验证资料。
医疗器械软件实质首次注册应列明所有核心算法的名称、原理、用途和类型,实质重新注册应列明本版新增核心算法的名称、原理、用途和类型。
现成软件
随着计算机技术的快速发展,医疗器械使用现成软件的情况越来越普遍,但是现成软件并不能完全满足医疗器械的全部预期用途。同时,由于未进行完整的软件生存周期控制,制造商使用现成软件的风险要高于自主开发的软件,但是仍然要对医疗器械后续的安全性和有效性负责。因此,制造商应采用基于风险管理的方法对现成软件进行管理。
对于部分采用现成软件的方式,外包、成品和遗留软件申报要求相同,已在前一章详细说明。对于全部采用现成软件的方式,申报要求如下:
1、外包软件应提供外包合同和软件描述文档;
2、成品软件应提供外购合同和软件描述文档(不适用内容应说明理由),如已在中国上市应提供产品注册证复印件和相应资料;
3、遗留软件应提供产品注册证复印件和软件描述文档(不适用内容应说明理由)。

来源:AnyTesting


