一、清洁工艺
附录是这么说:为确认与产品直接接触设备的清洁操作规程的有效性,应当进行清洁验证。其实和工艺验证是针对生产工艺一样,清洁验证针对的也是设备的清洁工艺。
然后就有个问题,我们的清洁工艺怎么做?针对这个问题,就有下面这张图。
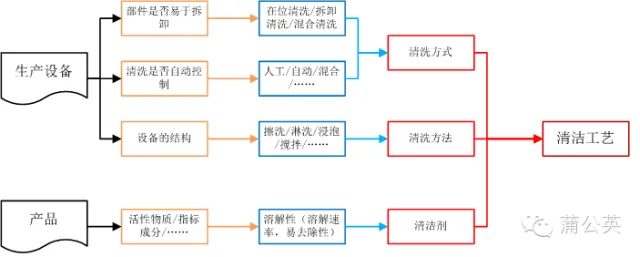
1.1 清洁方式和清洁方法
清洁,其实是对生产中使用的设备进行清洁,而设备的情况决定了设备的清洁方式和清洁方法。
1.1.1 设备清洗位置
在GMP中有这么依据话:如需拆装设备,还应当规定设备拆装的顺序和方法。所以在拿到设备的时候,我们就应该对设备稍微进行一下分析,设备是否可能进行拆卸,或者拆卸的难以程度。如果方便拆卸和安装,就可以将可拆卸后,在清洗间进行拆卸(异位)清洗;不易或不能拆卸的使用在位清洗;或者易于拆卸的部分拆卸使用异位清洗,不易拆卸或不能拆卸的部分进行在位清洗的混合清洗。就想我们的一台粉碎机,每次清洗,都要把里面的腔体内的各种东西卸下来才行。同样的,哪些不能进行拆卸或者移动的部分,就只能进行在位清洁了。
在确定确定设备是拆卸或者在位清洗以后,在结合人工清洗还是自动清洗,我们可以知道我们的设备清洗的方式:自动化(人工)在位(在线)清洗或人工(自动化)拆卸清洗。
1.1.2 设备清洗形式
在生产线设计之初,公司已经根据自己的情况,来对设备是由人工进行清洗,还是使用在线的自动清洗。当设备清洗使用CIP的时候,采用自动清洗;如果没有CIP就只能使用人工清洗了;当某些特殊的清洗CIP不能完全满足时候,就需要使用人工进行一些辅助,这个时候就是自动和人工同时存在的混合清洗形式了。这些需要在设备设计的时候就要进行考虑的。就像我们设备经理谈到了:我现在是人工清洗,但是我要为以后的自动清洁留下可能,当然了,至于这些可能如何达到,就是需要他进行考虑的了。
1.1.3 设备清洗方法
当知道了设备的在哪里清洗,使用人工还是自动清洗以后,根据它们之间的组合,就会产生针对设备及部件的清洗方法:浸泡清洗、擦拭清洁、淋洗或者其它合适的清洗方法。
1.1.4 清洗方式
设备及部件的可拆卸和安装的便利行,决定了设备是拆卸清洗、在位清洗或两个同时存在;设备清洗的自动化程度,决定了是使用自动清洗、人工清洗或混合清洗;结合上面两点,可以知道设备及部件采用浸泡清洗、擦拭清洁、淋洗或者其它合适的清洗方法;将这三个方面就会知道设备的清洗方式了。
1.2 清洁剂
在知道了设备的清洗方式以后,我们还需要知道:设备清洗要去除的哪些东西,使用什么样的清洗剂进行去除。而这些就是使用设备生产的产品所决定的了。
需要去除的是物质(活性成分、指标性成分、……)的物理或化学的性质决定了它们的溶解性、附着能力(决定被去除的难易程度)等性质,这些就决定了,在设备清洗过程为去除残留物使用的清洁剂,如水。
1.3 清洁工艺
确定了设备清洁方式、设备清洁方法及使用的清洁剂后,在结合清洁剂的性质(PH值、温度……)和清洁的参数(清洁剂流速、流量、压力……),就形成了一个完整的设备清洁工艺。
二、清洁验证
清洁工艺确定以后,我们需要对清洁工艺进行验证。在清洁验证中涉及到了:取样方法、取样部位(点)、残留限度以及取样回收率等内容。
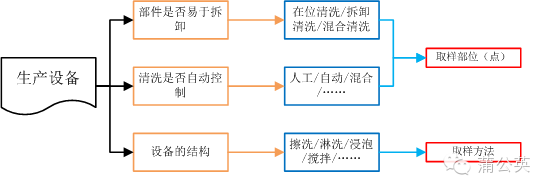
2.1 清洗验证取样方法和取样部位(点)的确定
其实取样部位和取样方法基本上是由设备来决定的
2.1.1 清洗验证取样部位(点)
设备及部件的易拆卸程度和清洗的自动化程度决定了设备清洗方式的同时亦决定了取样部位。例如:各种难以清洗到的部位以及自动清洗的排放口等位置。
2.1.2 清洗验证取样方法
设备的结构在决定了清洗方法(浸泡、淋洗、擦拭、……)的同时亦决定了取样方法,如最终淋洗液取样或擦拭取样。
2.1.3 设备与取样部位和取样方法的关系图
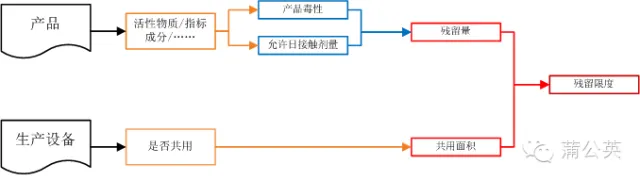
2.2 残留限度
残留限度是由产品的残留量和共用的生产设备共同决定的
2.2.1 残留量
在残留量确定过程中,验证与确认附录要求考虑两个东西:产品的毒性和日允许接触剂量。后一个大家都很清楚,不同的就是前者-产品毒性,现在普遍的说法这个是指药理实验的半数致死量。
同样,多产品共线的清洁验证,在代表性产品的选择上,也需要将产品毒性考虑进去了。在开展的培训中,也给出了使用毒性来计算残留量的公式,大家有兴趣的话,可以去找找。同时药理学也告诉我们,药品的半数致死剂量是远远大于日服用剂量的,所以一般情况下使用毒性数据得到的残留量远远大于使用日允许接触剂量数据得到的残留量,当然特殊情况除外。
现在流行的残留量计算方式就是:10ppm和上一产品在下一产品日最大服用剂量中的残留量不能超过自身日最小服用剂量的千分之一。现在的话,再加一个使用半数致死量计算的残留量,比较一下选择一个合适残留限度。
2.2.2 共用面积
在附录的清洁验证部分,有这么一句话:可接受标准应当考虑工艺设备链中多个设备潜在的累积效应。其实这句话也就是说产品在整条生产线上的残留总和也就是10ppm或者千分之一,而不是以前在每台设备上的残留都是10ppm或者千分之一。这么一来,只要知道了整个产品生产线上共用的设备,就知道了与药品直接接触的设备总面积。
2.2.3 残留限度
知道了产品允许的残留量,也知道了与药品直接接触的设备总面积,除一下就能知道在单位面积上的残留限度。
所以在对产品的共线情况进行分析以后,我们的清洁验证方案就可以进行合并了,反正共用的设备残留限度一样,那么在验证方案的前半段就是进行产品的选择、残留量、共用面积以及残留量的计算,弄些表格,洋气的说法就是弄些矩阵来进行说明。
2.2.4 下面这张图,是残留限度确定的一个关系图
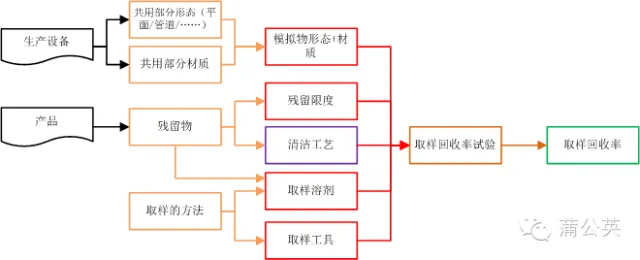
2.3 取样回收率试验
通过2.1知道了,清洗验证取样方法和取样部位(点),通过2.2知道了残留物的残留限度,按照清洁验证的流程,这个时候是QC按照方法去进行取样和检验了。既然是取样,那就要保证取样方法的有效性了,怎么保证:验证,通过取样回收率试验来证明取样方法的可行性
2.3.1 怎么做回收率试验
既然这里说的是回收率试验,那肯定不是直接在生产设备上来进行了, 这个时候就需要残留物的标准溶液涂布在于设备相同材质的板材或管道中,干燥,备用。
使用规定的取样工具和取样溶剂,按照取样要求的方法进行擦拭或者淋洗取样。样品按照要求进行处理以后,使用适合的检测工具对进行检测,计算出回收率。
2.3.2 取样回收率大概的关系图
2.3.3 可能会出现的问题
使用经过验证或确认的标准进行质量检验,已经是一个共识了,那在清洁验证里面就有了问题。
2.3.3.1 有残留限度要求,进行了取样,就会有残留物的检测限度问题,这是时候是不是对检验设备的灵敏度进行确认?应该是需要的
2.3.3.2 有了检测设备,也就有了检验方法,那是不是需要对残留物的检验方法进行确认或验证?也许需要吧。
2.3.3.3 也许就有了下面这个图

似乎整个回收率试验就是一个对残留物检验方法的一个确认或者验证的过程。
2.4 清洁剂残留和微生物限度
附录说了:应当根据所涉及的物料,合理地确定活性物质残留、清洁剂和微生物污染的限度标准。
2.4.1 清洁剂残留
附录还说了:如使用清洁剂,其去除方法及残留量应该进行确认。当使用的清洁剂会出来残留的时候,我们需要通过对清洁剂的残留量确认来证明其去除方法的有效性。这就要求,使用清洁的产品成分清晰,明确。在清洁剂成分不明的情况下残留量的确认比活性成分清洁验证难度大的多。
2.4.2 微生物限度
其实微生物限度,并不能真的算到清洁验证里面来,要混到一起的话也没有问题,毕竟清洗过程本身就是一个微生物的去除过程。当然,就个人而言更喜欢将微生物限度,作为一个清洗后消毒剂消毒效果的确认。
和清洁剂的要求一样,当使用的消毒剂会产生残留时,也需要对消毒剂的残留进行去除和确认。所以为了减少麻烦,设备消毒使用的消毒剂最好选择没有残留的,比如75%酒精。
2.5 清洁验证
将残留物的清洁验证、清洁剂的去除效果验证、消毒效果验证及消毒剂残留确认组合起来,可以看成是一个完整的清洁验证方案,当然了,不是要大家把这些都写到一个方案里面,而是根据实际的情况对这些验证进行拆分。
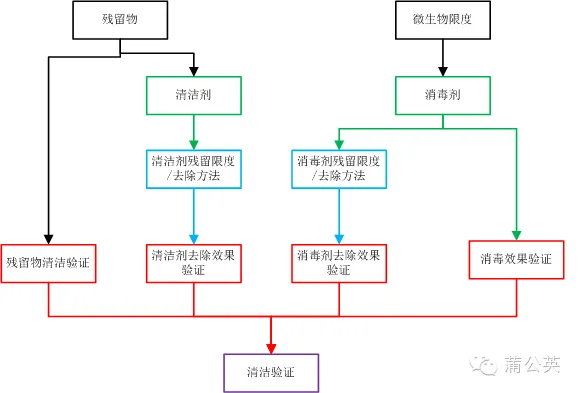
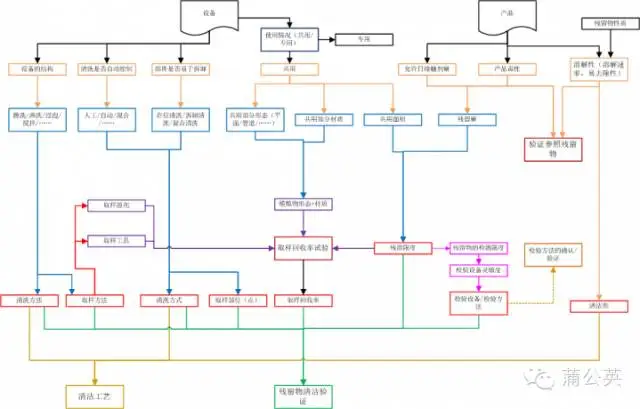
三、从清洁工艺到验证
上面写了很多,图也画了不少,最后将这图进行了拼装,就形成里面这张总图。在这张总图里面有添加了一些,前面没有说的东西,有兴趣的话,可以仔细看看
四、总结
4.1 上述内容是根据当时培训的需要做的一些东西,算是个人对清洁工艺和清洁验证理解的总结和梳理,因为经验和知识水平方面的问题,肯定还有很多的不足,所以各位看官看过以后,需要将各位的意见写一下。
4.2本文还有一个不足的部分就是没有针对附录中清洁验证部分的条款进行更多的说明。其实附录里面的清洁验证和10版GMP执行以后大家所做的清洁验证内容没有太大的区别,如果说有的话,也就是要考虑产品毒性了。
4.3 对于专线生产的产品是不是需要进行清洁验证,其实已经有了很多讨论,在清洁验证部分最后一条是这么写的:如无法采用清洁验证的方式来评价设备清洁效果,则产品应当采用专用设备生产。这句话反过来理解的话,就是使用专线生产的时候,可以不采用清洁验证的方式来评价设备的清洁效果。当然了,这个时候肯定要考虑其它的问题了。
4.4 其实清洁验证部分不仅仅是要求我们进行清洁验证。里面的一些内容其实是对我们现在清场中的大清和小清进行了相应的要求,如:当采用阶段性生产组织方式时,应当综合考虑阶段性生产的最长时间和最大批次数量,以作为清洁验证的评价依据。
4.5 其实很多的以前没有明确的东西,在确认与验证附录里面都进行了说明,大家有时间的话可以去多阅读几次条款。这个真的很有必要。


