您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-06-19 14:49
1. 有源医疗器械有效期限验证具体的评估分析方法有哪些?
根据国家药品监督管理局发布的《有源医疗器械使用期限注册技术审查指导原则》评价路径可分为整机或关键部件,具体的评估分析方法如下:
(1) 对产品/关键部件使用加速老化试验进行前瞻性研究,和/或用实时老化相关性进行验证;(2) 使用本产品或同类产品的经验进行汇总研究,其可能涉及样本的测试、安装使用情况、维修率或维修记录、投诉历史或公开文献的研究等;
(3) 对产品/关键部件的可靠性评估分析方法、模拟测试方法或其他理论及仿真计算方法。
以上方法均可以单独或组合采用。也可以采用其他合理、科学的方法。
2. 有源医疗器械有效期限验证采用加速老化试验具体的试验方案如何设计?
根据国家药品监督管理局发布的《有源医疗器械使用期限注册技术审查指导原则》通常试验方案设计步骤为:
(1) 确认评价方式,通常采用的评价方式为生产企业预设使用期限,或不预设使用期限通过试验结果分析后给定使用期限;
(2) 确认评价路径,结合产品本身系统结构特征确认评价路径为整机或关键子系统/部件进行评价;
(3) 评估使用频率和强度,结合产品临床使用场景特征评估预期临床使用的频率(工作时间、次数等);
(4) 确认产品预期临床使用时影响使用期限的因素,需结合临床使用场景如清洗消毒、使用环境温湿度、灭菌、振动等因素;
(5) 确认加速老化模型,根据《有源医疗器械使用期限注册技术审查指导原则》推荐标准GB/T 34986-2017《产品加速试验方法》选择相对应的试验模型;
(6) 确认加速因子,根据上述条件计算出加速因子AF;
最终确定加速老化试验时间进行产品加速老化试验(试验后对产品的安全性和有效性进行检测确认)
3. 有源医疗器械有效期限验证采用加速老化试验时加速老化模型如何选择?
根据《有源医疗器械使用期限注册技术审查指导原则》推荐标准GB/T 34986-2017《产品加速试验方法》常用的加速老化模型如下:
(1) 阿伦尼斯湿度模型(适用于环境温湿度引起的相关老化特征)
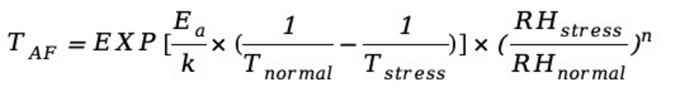
TAF:为加速因子; K常数:8.623×10-5 eV/K;
Tnormal:为正常使用/贮存温度; RHnormal:正常使用/贮存湿度;
Tstress:加速试验温度; RHstress:加速试验湿度;
Ea:激活能; n:湿度的加速率常数;
(2) 逆幂律模型(适用于动态应力和气候应力引起的相关老化特征)
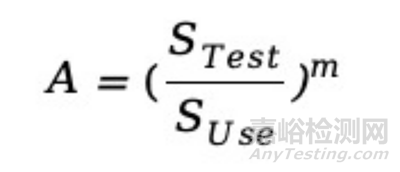
STest,测试应力;
SUse,正常使用应力;
m,与应力相关的待定参数;
(3) 艾林模型(适用于温湿度应力和化学反应引起的相关老化特征)
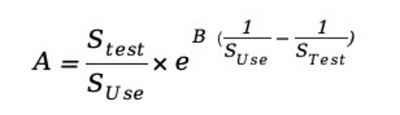
STest,测试应力;
SUse,正常使用应力;
B,待定参数,可通过试验或参考文献的数值进行确定;
4. 有源医疗器械有效期限验证采用加速老化试验时试验温度应力应如何选择?
当选取温湿度应力进行加速老化试验时,应充分考虑试验温湿度的选取,如果温湿度过高则会导致产品过早的发生失效,不利于产品的试验实施。在选择具体数值时因考虑以下因数:
(1) 产品本身系统特征(如大功率设备、系统具有软件温度保护温逻辑等)
(2) 产品本身材料特征(如电子器件、绝缘壳体、结构件等材料耐热性)
(3) 产品本身结构特征(如内部散热方式、壳体散热设计等)
综上所述,如产品非大功率设备无热源、内部及壳体散热设计优良,产品不涉及温度保护,结构壳体材料为普通材质(如ABS、PVC、PA等),极限破坏应力>60℃等因素下,建议试验温度设定值不大于60℃。较高的温度(如高于聚合物玻璃化转变温度)可能导致医疗器械原材料、组件和/或包装材料的性质发生改变或引发多级或多种化学反应,造成试验结果的偏差。

来源:Internet


