一、申报资料发补率统计
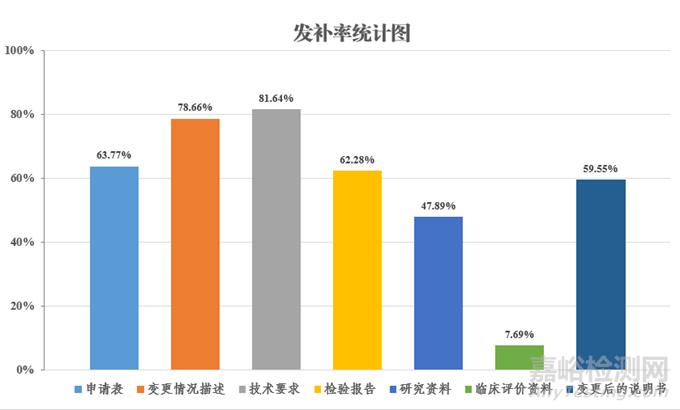
2023年度,江苏省药监局审评中心共接收医疗器械变更注册申报427件,发补403件,变更注册发补率94.38%。审评发补意见主要集中在申请表、变更情况描述、产品技术要求(仅需上传变更情况对比表)、检验报告、研究资料、临床评价资料和变更后的说明书七部分(发补率统计详见图1)。其中,
◆申请表发补率63.77%
◆变更情况描述发补率78.66%
◆产品技术要求发补率81.64%
◆检验报告发补率62.28%
◆研究资料发补率47.89%
◆临床评价资料发补率7.69%
◆变更后的说明书发补率59.55%
图1 变更注册技术审评常见资料发补率统计图
二、变更注册申报常见问题分析
1、申请表
注册申请表是注册流程中最先审查的文件,记录着医疗器械产品的基本信息。在企业申报过程中,发现主要存在以下几点问题:
(1)产品新增型号,新增的型号与老型号技术原理、结构组成、性能指标、适用范围不同时,未根据《医疗器械注册单元划分指导原则》及相应产品的指导原则划分为不同注册单元。
(2)申请表中“许可事项变更注册”的勾选存在漏选错选问题。如:产品技术要求中有产品型号信息,申报产品型号发生变化,“许可事项变更注册”未勾选“产品技术要求变化”项。
2、变更情况描述
(1)未使用制式表格《江苏省第二类医疗器械(含体外诊断试剂)变更情况对比表》。
(2)变更情况描述不全面,变更原因未明确。
(3)变更情况描述与其他申报资料内容不一致。
3、产品技术要求(仅需上传变更情况对比表):
(1)未使用制式表格《江苏省第二类医疗器械(含体外诊断试剂)变更情况对比表》。
(2)未按要求仅上传变更情况对比表;
技术要求中发生变化的条款及内容未在对比表中体现。
(3)性能指标变更不合理;
新增型号性能指标不全面,检验方法不合理;
引用作废标准,未标明引用标准的年号或标准号有误。
(4)检验方法与检验检测机构盖章版技术要求中的检验方法不一致。
4、检验报告
(1)注册检验样品的生产地址未包含注册申请表中的“生产地址”,检测报告无效。
(2)新增的型号不能被老型号覆盖,未对新增的型号进行型式检验;
检验报告样品描述未包含所有新增型号;
若新增型号能被老型号覆盖,未出具关于型号覆盖的说明。
(3)检验报告未能完全涵盖产品变更部分性能指标;
技术要求中检验方法发生实质性变化,未提供相应的检验报告。
(4)产品结构组成发生的变化影响产品性能指标,性能指标未进行检测。
(5)检验报告未加盖检验检测机构的检验检测专用章或者公章,授权签字人未签字。
(6)对产品技术要求完全采用国家标准、行业标准的,检验报告未加盖资质认定标志CMA章;
产品技术要求不涉及或部分涉及国家标准、行业标准的,检验报告未加盖CMA章时,未在报告书备注中对承检能力予以自我声明,承担相应的法律责任。
(7)提供的检验报告未包含样品照片和说明,或样品的照片和说明未体现产品的包装、标签、样品实物图、内部结构图(如适用)等。
(8)提供自检报告的,未按照按《医疗器械注册自检管理规定》提交相关资料。
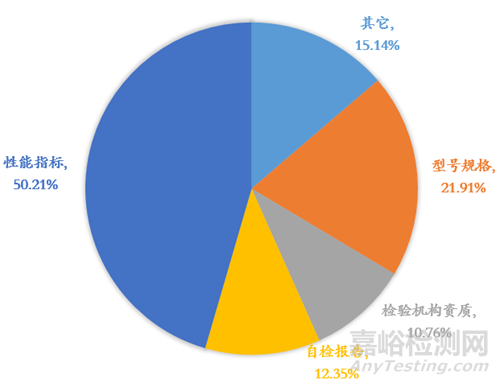
图2 检验报告发补原因统计图