前言
手足口病是一种常见于5岁以下幼儿的病毒性疾病,其典型表现为口腔疱疹和手足皮疹。早在1957年,多伦多就首次报道了由柯萨奇病毒(主要是CVA16)引起的发烧、手脚水泡性皮疹的特征性症状。1959年,“手足口病”被首次用来命名这种症状的疾病。
在过去的几十年里,由EV-A71、CVA16、CVA6和艾可病毒引起的手足口病疫情在世界各地频繁报道。EV-A71于1969年首次从一名脑膜炎儿童身上分离出来,在亚太地区的大部分地区引起了手足口病的广泛爆发。这种疾病症状通常较轻,在大多数情况下持续不到一周,然而,也有相当多的患者会出现致命的神经或心肺并发症。此外,最近的随访研究表明,严重疾病康复的患者可能会出现严重的神经后遗症。因此,手足口病已成为整个亚太地区乃至全球公众健康的一个重大问题。
目前,还没有针对手足口病的特定药物干预措施。中国食品药品监督管理局(CFDA)批准的肠道病毒A71灭活疫苗已被证明对EV-A71相关手足口病具有高水平的保护作用。然而,多种病原体的同时传播和传染源分子流行病学的演变使得仅基于单一病原体的干预措施相对不足。肠道病毒具有高度传染性,对神经系统有偏好,尤其是在儿童人群中,这导致了持续的疫情爆发。鉴于手足口病在世界各地的巨大影响,我们需要深入了解手足口病病毒学、流行病学、发病机制、治疗、后遗症和疫苗开发的最新发现,以便更好地提供临床实践和公共卫生措施。
手足口病的流行病学特征
手足口病的潜伏期大多为2-10天,平均为3-5天。手足口病的进展可分为5个阶段(皮疹、神经功能障碍、心肺功能衰竭早期、心肺衰竭、恢复),大多数病例通常只经历第一阶段,并在一周内恢复。
人类通常被认为是人类EVs的唯一宿主,患者和无症状感染者都是手足口病感染的来源。该病毒可以在感染者发病前几天在咽部和粪便中检测到,通常在症状出现后一周内最具传染性。目前,粪口传播和接触被认为是手足口病的主要传播途径。基于一些动物研究,也提出了气溶胶和呼吸道的潜在传播途径。
作为一种常见的儿童传染病,手足口病主要发生在5岁以下的儿童。由于免疫系统不成熟和幼儿园前阶段的聚集性,儿童对EV非常敏感。除了减少易感人群的聚集和加强个人保护外,通过疫苗接种的“群体”免疫在降低人群易感方面更有效。在中国EV-A71高传播的城市地区,已开始接种灭活的EV-A71疫苗,观察到与EV-A71相关的手足口病发病率显著下降。EVs可以刺激更强的免疫反应,但不同血清型之间几乎没有交叉免疫。因此,迫切需要多价疫苗来进一步提高群体免疫力。
手足口病的病因特征
手足口病是由人类肠道病毒(EVs)引起的,EVs是小核糖核酸病毒科肠道病毒属的成员。EVs的病毒颗粒是对称的二十面体,由60个外壳蛋白亚基和一个正极性的单链RNA组成。病毒基因组的开放阅读框(ORF)编码2194个氨基酸,3′非翻译区UTR(3′UTR)后面是可变长度的Poly-A尾部。病毒基因组编码的蛋白质主要包括三个区域:P1、P2和P3,其中P1编码四种结构蛋白VP1-VP4,P2和P3分别编码七种非结构蛋白2A-2C和3A-3D。VP1-VP4进一步参与病毒粒子衣壳组装。尽管VP1、VP2和VP3排列在衣壳的外侧,但VP1是主要的抗原结合位点。因此,VP1是主要血清学分型和疫苗开发的合适候选者,并已被广泛用作EVs分子研究的靶基因。
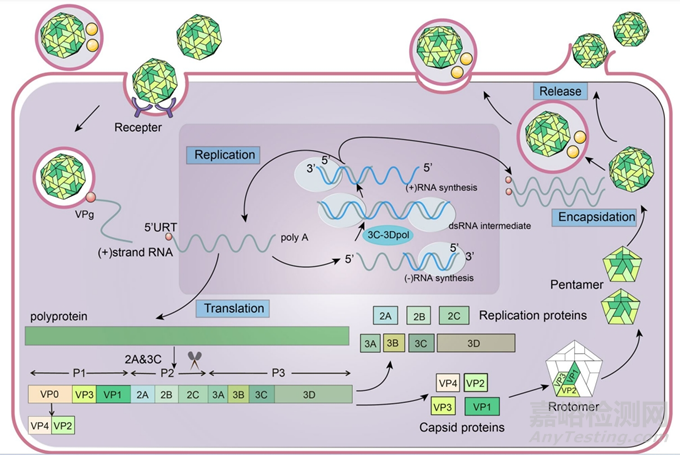
此外,EV的物理化学特性包括对醚、氯仿等有机溶剂和低温条件的耐受性,以及对高温、氯化消毒剂、甲醛和紫外线等的敏感性。
引起手足口病爆发的4种主要EV血清型
在过去,EV-A71和CVA16是2005年之前最常报告的手足口病病因。目前,其他EV,如CVA6和CVA10,在手足口病病例和疫情中占很大比例。
EV-A71毒株于1969年在加利福尼亚州首次分离。1970年至1990年期间,由EV-A71引起的手足口病疫情在美国频繁发生。二十世纪末,EV-A71在整个西太平洋地区的活动急剧增加。1997年,由EV-A71毒株在马来西亚引起的手足口病大爆发导致41人死亡。2008年至2014年,中国共报告10717283例病例(3046例死亡),病死率为0.03%。发病率从2008年的37.6/100000上升到2013年的139.6/100000,并在2012年达到166.8/10 0000的峰值。
CVA16是1959年和1994年英格兰手足口病爆发的主要病原体。1964年和1968年,美国也爆发了CVA16疫情。CVA16感染也是1991年澳大利亚悉尼爆发手足口病的原因。随后,亚太地区包括中国、日本、印度、台湾、越南、新加坡和欧洲的西班牙都报告了CVA16疫情。
近年来,随着EV-A71疫苗的接种,手足口病的致病谱发生了变化,尤其是在中国。从2016年到2018年,在中国杭州的3559例手足口病病例中,EV-A71和CVA16阳性的比例分别为8.9%和5.2%,而其他EVs的比例为60.6%。近年来,由CVA6引起的手足口病疫情已在美国、西班牙、匈牙利、法国和英国发生。与其他EV血清型引起的手足口病不同,CVA6相关手足口病表现出更严重、更广泛的皮疹,其特征是成人发病率更高。
CVA10毒株于1950年在美国首次分离。CVA10的第一次爆发发生在1981年7月至1982年1月的日本。随后,亚洲、欧洲、非洲和大洋洲相继报告了与CVA10相关的手足口病与CVA6共同传播。中国手足口病患者CVA10的检出率不同。CVA10(25%)、CVA6(29.8%)和CVA16(32.5%)是2018年广东省手足口病患者最常见的血清型。在厦门,从2009年到2015年,手足口病病例中CVA10的比例并不是特别高(1.08–7.09%)。然而,严重手足口病患者的CVA10检测率明显高于往年。2016年至2020年,上海共收集到9952例散发性手足口病病例,CVA10为第四大流行病原体,总阳性率为2.78%。
EV-A71、CVA16、CVA6和CVA10是全球引起手足口病的4种主要毒株,它们又具有不同的亚型。EV-A71病毒的遗传进化可分为七种基因型(A-G),其中基因型B和C分别进一步分为B0-B5和C1-C5亚型。C4和C1亚型已发展成为最主要的毒株,C4亚型主要在东亚和东南亚传播,而C1在欧洲流行。CVA16分为A和B两个基因型,B基因型进一步分为B1和B2。B1可以进一步分为B1a、B1b和B1c。CVA6毒株可分为6种基因型,分别为A至F,D基因型可进一步细分为D1-3亚型。近年来,D基因型,特别是D3亚型,已成为东南亚和欧洲流行的显性亚型。CVA10分为7个基因型,包括A到G。C和D基因型是全球主要的流行毒株。由于进化压力和频繁的重组,手足口病的病原体已经进化成具有特定时空分布的各种EVs基因型,进一步的基因组分析和持续的分子流行病学监测有助于疾病的控制和预防。
手足口病的病理学特征
病毒受体在感染的初始阶段起着至关重要的作用。病毒进入的第一个要求是与宿主细胞表面的受体结合,从而触发下一步的内吞作用。受体的可用性通常限制病毒感染并影响组织和物种的特异性。目前,EVs的大多数受体属于免疫球蛋白超家族(IgSF),是I型跨膜糖蛋白。如表所示表2,2, hSCARB2、PSGL-1、Annexin II、硫酸乙酰肝素被鉴定为EV-A71的主要受体,KREMEN1被确认为CVA2、CVA3、CVA4、CVA5、CVA6、CVA7、CVA10、CVA14、CVA16的主要受体。受体的多样性和各种结合模式促进了EVs的感染。
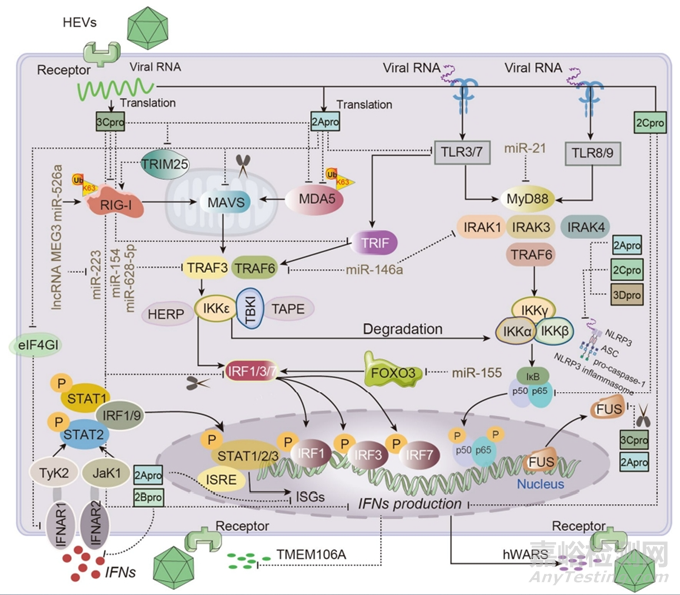
EV的固有免疫逃逸
对病毒的最初防御是激活感染部位IFN和其他抗病毒分子的分泌,并通过自分泌和旁分泌机制发挥其抗病毒作用。宿主细胞通过三种病原体识别受体(PRRs)识别病原体相关分子模式(PAMPs):toll样受体(TLRs)、视黄酸诱导基因样受体(RLRs)和核苷酸结合寡聚结构域类受体(NLRs)。
EVs已经进化出各种策略来抑制由IFNs介导的抗病毒反应。2Apro和3Cpro直接抑制IFNs的产生和IFNs受体的表达。EVs主要作用于PRR信号通路中的多种蛋白质分子,以完成免疫逃避。EVs主要通过控制宿主非编码RNA(ncRNA)的水平来抑制TLR依赖性信号传导,从而间接影响TLR感知宿主细胞的能力,以及切割下游分子MyD88和TRIF以阻止IFNs的产生。EVs除了参与常见的先天免疫信号通路外,还直接抑制抗病毒蛋白分子,如ZAP和酰基辅酶A氧化酶1(ACOX1)。它们还间接靶向泛素化的关键蛋白,如Ubc6e,以诱导细胞凋亡和自噬,最终加剧病毒感染。
对EVs的适应性免疫
人体适应性免疫也进化为提供更广泛、更复杂的识别机制来消除病毒。临床证据表明,EVs可以引发针对同型病毒的中和抗体(NAb)。一项研究结果表明,NAb滴度在发病后2周内迅速达到峰值,并在2年内保持在高水平。此外,有研究认为,对决定EV-A71感染的结果有更大影响的是细胞免疫反应,而不是体液免疫。T细胞进行的细胞免疫对维持身体防御至关重要。活检显示患者CD4+T细胞和CD8+T细胞发生异常变化。感染EV-A71的儿童外周血样本中显示Th(辅助T细胞)、Tc(杀伤T细胞)和Treg细胞(调节性T细胞)的总数减少,B细胞、Th2细胞和Th17细胞的百分比增加。此外,在轻度和重度手足口病感染的儿童中,Th1/Tc1和Th17/Treg显著增加。快速有效的免疫反应是抵御病毒感染的坚实防线。然而,过度和失调的免疫反应会引发一系列连锁反应,主要表现为具有神经源性成分的全身免疫失调。
手足口病的细胞因子谱
研究发现,健康个体、轻度手足口病患者和重度HFMD患者的细胞因子水平显著不同,这表明细胞因子在疾病进展中发挥着关键作用,并为诊断和治疗提供了潜在的靶点。参与细胞因子产生的先天细胞包括中性粒细胞、巨噬细胞和自然杀伤细胞。同时,参与“细胞因子风暴”的适应性细胞主要是各种亚群的T细胞。全身炎症通常与伴随中枢神经系统损伤的血脑屏障破裂有关,这导致脑源性促炎细胞因子进入循环,进一步激活包括补体在内的炎症级联反应。
例如,在检测到的淋巴细胞趋化因子中,在严重手足口病患者的血浆和脑脊液中发现了高水平的干扰素γ诱导蛋白-10(IP-10)。研究显示,IP-10的缺乏显著降低了血清中Mig(由IFN-γ诱导的单因子)的水平,以及小鼠大脑中IFN-γ的水平和CD8+T细胞的数量,这反过来又导致EV-A71感染小鼠的死亡率增加。此外,趋化因子配体CXCL-10在EV阳性脑膜脑炎小鼠中显著上调,CXCL10/CXCR3轴的进一步干扰会降低危重小鼠器官中白细胞、中性粒细胞和巨噬细胞的水平。最终,免疫系统崩溃,宿主的多个器官受损,导致不可逆转的多器官衰竭和死亡。
手足口病疫苗的开发现状
接种疫苗被认为是控制手足口病发病率的最有效和最具成本效益的方法。目前,有针对手足口病病原体的单价和多价疫苗。单价疫苗主要包括灭活全病毒疫苗、合成肽和蛋白质疫苗、重组亚单位疫苗和重组病毒载体疫苗。目前,FDA未批准任何肠道病毒疫苗在美国使用。在中国已批准的手足口疫苗均为EV-71单价疫苗,生产企业为科兴生物,武汉生物和医科院生物所。
中国一项随机、双盲的3期试验结果显示,EV71灭活疫苗的有效率为97.4%。CVA16、CVA10、CVA6和CVA5的单价灭活病毒候选疫苗仅在动物模型中进行了研究,缺乏保护的临床证据。2018年1月,康泰生物及全资子公司北京民海联合申报的重组肠道病毒71型疫苗(汉逊酵母)获得药物临床试验批件。2023年12月,重庆博唯佰泰生物制药有限公司申报的重组肠道病毒71型疫苗(汉逊酵母)I期临床试验完成招募。
然而,单价疫苗提供的保护范围有限,仅针对一种基因型,这意味着它们不能对其他EVs相关的手足口病提供保护。因此,降低手足口病发病率的最有效方法是使用多价疫苗,这些疫苗是通过有效的单价疫苗的组合或构建具有不同病毒血清型的嵌合疫苗开发的,可以提供更好的交叉反应性和保护。目前,灭活的多价疫苗,包括二价、三价和四价疫苗。2023年7月,科兴生物申报的二价肠道病毒灭活疫苗(Vero细胞)临床申请获批,并于年内开展I期临床研究。2023年9月,医科院生物所申报的EV71-CA16二价灭活疫苗(人二倍体细胞)临床申请获批。
参考文献:
1.Current status of hand-foot-and-mouth disease. J Biomed Sci.2023 Feb 24;30(1):15.






