在问到一些新建企业的质量管理体系建立进度时,常常回答说:嗯,我们有**个文件,现在完成了**,大约会在什么时候完成。。。还有的会说,我们有某某企业的文件模板,所以巴拉巴拉。以及:你有没有某某文件的模板,能不能给我们巴拉巴拉。
难道,质量体系的建立,只是完成GMP文件多少个吗?
考核质量体系的建立与否,只是有没有完成文件体系吗?
所以,是不是应该考虑一下质量量度Quality metrics呢?一个成熟的质量体系,最终体现出来的,当然应该是合格率的保证和持续提升、投诉退货率的降低和持续下降,以及,比如偏差和实验室错误的发生率、变更控制的效果与及时性、产品回顾中的良好趋势、质量风险管理的有效、对产品生产和质量控制的知识管理的不断提升。。。
那么,到底怎样去看质量体系的建立与否、体系水平呢?
带着这个问题,最近,我又开始重新研究FDA的《药品CGMP符合性的质量体系方式》指南,重新理解质量体系,以及六大体系的关系:
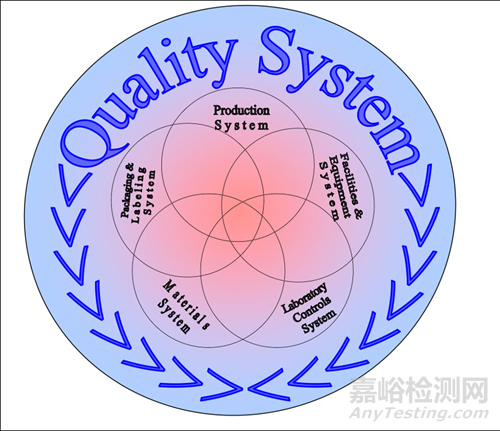
1. 六大体系思路
生产、设施设备、实验室控制、物料、包装贴签五大体系涵盖在质量体系内,它们之间也相互交联。这个意思,盯着这个图中的几个圈圈多看几眼,自然就很容易理解。
FDA提出的这六大体系思路,并不是建立质量体系的指引,而是FDA对药品生产企业的检查框架。顺着这个六大体系图,再去看FDA的CPGM7356.002,在每个体系的检查重点前,都有这样一句话,不厌其烦地重复了六次:
对以下内容,企业应当具有书面批准的程序和由此产生的记录。应当尽可能观察核实企业是否遵守了这些书面程序。检查领域不仅限于成品,也可能包含组分和过程物料。这些领域可能表明不仅本系统存在缺陷,而且其它系统也存在需要扩大涵盖范围的缺陷。检查时除了质量体系以外,还选择这个体系来检查时,下列内容都应当涵盖,只不过涵盖的深度可能因检查结果而异。
FDA对工厂的检查是基于风险的方式。他们把工厂管理分成六大体系,除了质量体系必检以外,其它体系根据具体的产品、风险情况选择性检查。所以,他说如果选择了检查这个体系,那这下面的内容都要检查。如果发现问题,不仅仅是这个体系有问题,其它体系也可能存在相关的问题或者问题的原因,可能需要扩大检查范围。
这,也是对图形中那几个圈圈之间涵盖与互相交叠部分的实际说明。五大体系的圈圈除了都在质量体系内以外,任何一个圈圈都与另外四个圈圈全部有交叠。
2. 制剂生产企业的质量体系
制剂企业的六大体系检查程序,在CPGM7356.002中(最近更新:2022年9月16日)。
在质量体系的检查内容之前,有这样一段话:
对质量体系的检查评估分两个阶段。第一阶段是评估质量部门是否有充分的职责去审核和批准所有与生产、质量控制和质量保证相关的程序并确保程序充分适合于其预期的用途,包括相关的记录保存系统;第二阶段是评估收集的数据来发现质量问题。而这些质量问题可能链接至检查范围内的其它主要体系。
制剂企业质量体系的检查重点,包括16大方面:
1)对委外操作和物料供应商的质量监管;
2)对质量体系的建立、实施、监督和持续改善管理(将质量风险管理与知识管理相结合);
3)质量风险管理程序;
4)产品回顾;
5)投诉审核;
6)差异与失败调查;
7)对所生产的所有产品的变更管理;
8)批准的申请产品的变更报告;
9)否决Rejects;
10)稳定性失败;
11)隔离产品;
12)验证;
13)cGMP人员的培训和资质确认;
14)在整个产品生命周期内持续监测产品质量和工艺性能的程序;
15)返工/再加工;
16)退货/补救
3. 原料药生产企业的质量体系
原料药企业的六大体系检查程序,是在CPGM7356.002F中(最近更新时间2015年9月11日)。
在质量体系的检查内容之前,同样也有类似的检查的两个阶段的话:
同样,在质量体系和其它每个体系的检查重点之前,也有要有书面程序、发现的缺陷可能关系到其它体系的缺陷等等这样一段话:
原料药企业质量体系的检查重点,包括14大方面:
1)确保实现质量单位职责的充足的员工
2)定期的产品质量回顾
3)投诉审核
4)与生产和检测相关的差异和失败调查
5)变更控制
6)退货/补救
7)否决
8)原料放行系统
9)自上次检查以来生产的批次,以评估由于工艺问题而造成的否决或用途转变(例如,从药用转为非药用)
10)返工/再加工
11)召回
12)稳定性失败
13)验证
14)质量控制单位职能的人员的培训和资质确认
对原料药的QS检查,参考规范是ICH Q7的以下章节:
第2章:质量管理
第13章:变更控制
第14章:物料否决和回用
第15章:投诉和召回
第16章:委托制造商(包括实验室)
QS检查重点,制剂企业的16条和原料药企业的14条对比,除了制剂的已批准药品的变更报告这个内容更多的与美国的药品监管要求相关以外,其它项目的不同,有些是由于原料药与制剂管理内容或重要程度不同,有些,可能是因为程序更新时不够完善。比如:
在制剂QS中列出但原料药QS中未列出的:
制剂2)质量体系的开发实施监测完善,原料药企业同样需要重视;
制剂3)质量风险管理程序,原料药企业也应该重视。风险的直接影响不同,但风险的识别管理相同。原料药的生命周期中实施质量风险管理,对于杂质引入来说更是源头管理。
制剂11)隔离产品,对原料药管理来说应该对应的是防止差错和混淆。
制剂14)在整个产品生命周期内对工艺性能和产品质量的持续监测,特别强调这一点,是强调要将出现的重大问题报告给高层管理者。而对原料药来说,工艺性能和产品质量的持续监测,则通过产品回顾、验证、变更控制来实现,并持续改善。
制剂1)对委外操作和物料供应商的监督管理,对原料药来说也是需要管理的。而原料药8)有个原料放行系统,除了适当性的评估后批准放行以外,也可以关联到供应商的性能监督活动中。
在原料药QS中列出而制剂QS未列的:
原料药1)确保实现质量单位职责的充足员工,对制剂来说也是重要的,也许这项内容包含在了制剂2)质量体系中。
原料药9)自上次检查以来生产的批次中由于工艺问题造成的否决和转为它用的情况,对制剂来说,“否决”这项中已经包括了,而转为它用,对制剂来说基本不存在,但是,在实际工作中,是存在不合格的制剂转给原料药企业的可能性的。