医疗器械在注册取证环节,设计开发的工作是重中之重,也是审评老师质疑最多的一个环节。
项目的技术层面,研发工程师一般都胸有成竹,底气十足,在各种审评过程中,都能轻松应对。
而容易出问题的,或者被大家疏忽的,往往是设计开发过程的合法、合规层面的工作。
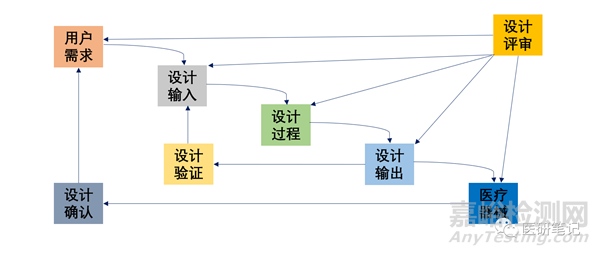
本公众号将设计开发过程分成了几个模块,陆续进行了介绍。
前几篇聊了设计输入、输出、验证等内容,有需要的朋友可以翻阅。
本篇谈一下设计开发过程另一个重要的活动——设计确认。
这里谈的不是过程确认,也不是3Q确认。
首先恭喜大家,进入了设计确认阶段。
这一阶段的工作比较轻松愉悦。
完成了设计主体工作,即进入了项目设计的总结阶段,编写设计确认方案和报告。
NO.1 设计确认的意义
GB/T 42061-2022明确指出,为确保产品能够满足规定的应用要求或预期用途要求,应依据策划并形成文件的安排对设计和开发进行确认。
具体是指,需要提供客观证据,来确定预期用途得到满足。
比如负压引流袋,需要提供临床评价资料等证明该产品具有负压引流的预期用途。
NO.2 设计确认的过程
1)编写设计确认方案
可以根据公司内部的《设计和开发控制程序》编写本项目的设计确认方案,方案中应识别设计项目指标、被确认的样品、确认方法,接受标准,样本量原理的统计技术(适当时)等。
2)编写设计确认报告
设计确认报告是审查老师必查的一个文件,大家应重视。
设计确认报告中包括但不限于以下内容:
a) 应对每一个预期用途进行确认,比如器械预期用途是保护和消毒,那么设计确认必须要证明这两个预期用途。
b) 需要对标签和说明书的可用性、易理解性,进行设计确认。可以依据《医疗器械说明书和标签管理规定》逐条进行确认。
c) 产品有效期的确认,应通过产品稳定性研究(一般为加速老化)来确定医疗器械的有效期,分为包装的有效期(无菌包装产品)和产品的有效期。
d) 临床评价的确认,可用豁免临床试验的方案、同品种评价的方式或者临床试验的方式进行评价。
e) 运输、贮存稳定性的确认,确定产品已经做了运输稳定研究。
f) 生物相容性测试,根据GB/T 16886.1进行生物相容性评价。
g) 软件的确认,如果含有软件的,应对软件进行确认。
h) 产品预期用途要求连接其他器械的,应对接口进行确认,并满足规定要求。
i) 风险分析确认,依据GB/T 42062-2022的方法,对产品进行风险分析确认。
3)设计确认评审
组织会审,对上述确认报告进行评审,涉及技术人员、质量人员、生产人员、法规人员、销售人员等,注意评审条款需要回避本部门的工作内容。
NO.3 设计确认的注意事项
1)选择有代表性产品进行
选择确认的样品不能是原理样品(或样机),必须是采用成熟稳定工艺生产的产品批次,应选择有代表性产品进行,代表性产品具有所有型号的覆盖性,并记录选择的理由。
2)与设计验证的区别
不要与设计验证混淆,设计验证和设计确认是两个重要的阶段,两者相辅相成。验证注重技术指标;确认注重预期用途。一般是验证后,再进行确认。
3)设计确认的产品,不能放行销售
用于确认的产品(临床评价或性能评价的医疗器械)不能放行给顾客使用。
4)保留记录
应保留确认结果和结论及必要措施的记录。