我们都知道,MDR新增了一个产品的类型,即无预期医疗用途的产品。该类型产品在MDR的附录XVI中有所规定。因此通常又被称之为附录XVI产品。对该类型产品的通用指南(CS)(2022/2346 和2022/2347)已经于不久前公布。最近,2023年12月14日,欧盟又连续发布了两份有关这类型产品的指南,分别是MDCG 2023-5(分类鉴定)及MDCG 2023-6(等同性验证)。
MDCG 2023-5无预期医疗用途产品的鉴定及分类
该指南先明确指出无预期医疗目的的产品的鉴定先于其分类。只有符合器械资格且CS和MDR涵盖的产品才应根据MDR附录VIII和(EU)2022/2347中关于重新分类的规则进行分类。
非医疗用途产品的鉴定:
MDR附件XVI中所列产品组的描述包括法规本身未详细定义或解释的术语或概念。MDCG2023-5中对这些术语或概念进行了澄清。
另外指南中还列举了被排除在附录XVI产品之外的情况。
无预期医疗用途产品的分类:
第一组:隐形眼镜
IIa:短期使用的隐形眼镜(如:彩色非矫正隐形眼镜);
IIb:长期使用的隐形眼镜(如:有色非矫正隐形眼镜)。
第二组:通过侵入性手段植入体内以改变解剖结构的产品
IIb:所有植入式器械和长期使用的外科侵入性器械(如:皮下植入物、臀部植入物);
III:如果它们被全部或者大部分吸收(如用于隆胸的可吸收缝合线);
III:如果是乳房植入物或是外科疝补片(如乳房植入物,用于隆胸的疝补片)。
第三组:用于面部或其他真皮或粘膜填充的产品
IIb:所有植入式器械和长期使用的外科侵入性器械(如永久性真皮填充物)
III:可分解的真皮填充物。
第四组:旨在减少、去除或破坏脂肪组织的器械
I:旨在减少、去除或破坏脂肪组织的器械,其中所有非侵入性器械及可重复使用的瞬时使用的外科侵入性器械;
IIa:一次性使用的外科侵入式器械;
IIb:旨在减少、去除或破坏脂肪组织的器械(如吸脂器械)。
第五组:治疗用高强度电磁辐射发射器械
IIa:仅用于人体脱毛的高强度电磁辐射发射器械(如向人体提供能量、与人体交换能量或提供将被人体吸收的能量的激光和 IPL 器械)。
IIb:拟用于人体皮肤治疗的高强度电磁辐射发射器械(如用于皮肤表面重修、疤痕去除、纹身去除或用于治疗痣、血管瘤、毛细血管扩张和色素沉着的皮肤区域的激光或 IPL 器械)。
第六组:用于脑刺激的器械
III:该类别包括应用电流或磁场或电磁场以改变大脑中神经元活动的脑刺激器械(如经颅磁刺激或经颅电刺激器械)。
MDCG 2023-6无预期医疗用途的等同性验证器械等同性证明指南
在指南中,无预期医疗用途器械等同性证明存在三种情况,具体如下:
1、两种无预期医疗用途的器械
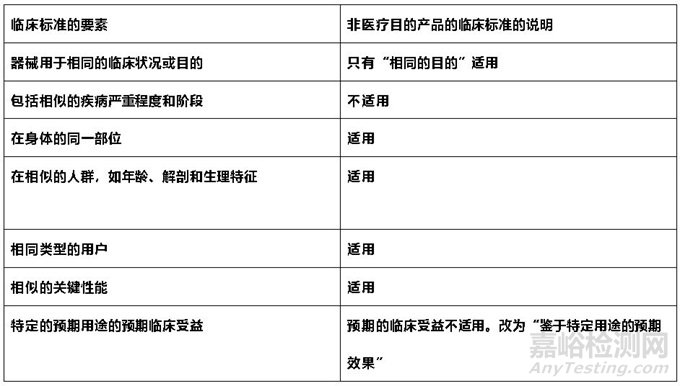
在参考等同器械的临床数据时,制造商应根据MDR中制定的标准证明两种无预期医疗用途的器械之间的等同性,其中重点考虑技术、生物学和临床特征等方面。
MDR中列出的技术和生物标准可以直接用于比较无预期医疗用途产品的特性,部分临床特征的标准是专门针对医疗用途的。指南以表格的形式阐明了无预期医疗用途产品应如何考虑其特性进行等同性的证明
2、无预期医疗用途器械vs类似医疗器械
通常,医疗器械和无预期医疗用途的产品之间不可能进行直接的比较,因为并非所有临床特征都能进行比较。特别是"疾病的严重程度和阶段相似 "这一特征对于医疗器械来说是可以的,而对于无预期医疗用途的产品来说是无法定义和获得的。因此,无预期医疗用途的器械与有医疗用途的类似器械之间无法完成和建立等同性证明。
3、无预期医疗用途器械vs双用途医疗器械对于同时具有医疗和无医疗用途的器械(双用途器械),只有无医疗用途相关的一般安全和性能要求的临床数据才能用于无预期医疗用途产品的临床评价。