今日头条
君实BTLA单抗启动国际Ⅲ期临床。君实生物BTLA单抗tifcemalimab(JS004/TAB004)在国内登记启动一项Ⅲ期临床,拟评估PD-1特瑞普利单抗联合或不联合Tifcemalimab作为局限期小细胞肺癌放化疗后未进展患者的巩固治疗的有效性与安全性。这是一项国际Ⅲ期临床,计划在中国、美国、欧洲等地入组756例患者。该试验的中国部分将由山东第一医科大学附属肿瘤医院医学博士于金明担任主要研究者。
国内药讯
1.贝达EGFR-TKI获批一线治疗肺癌。贝达药业靶向T790M的第三代EGFR-TKI甲磺酸贝福替尼胶囊获国家药监局批准第二项适应症,用于一线治疗EGFR外显子19缺失或外显子21(L858R)置换突变的局部晚期或转移性非小细胞肺癌(NSCLC)患者。在Ⅱ/Ⅲ期研究(IBIO-103)中,与对照治疗相比,贝福替尼可降低51%的疾病进展或死亡风险。今年6月,该新药已获CDE批准既往使用EGFR-TKI耐药后产生T790M突变的局部晚期或转移性NSCLC患者。
2.卫材/渤健Aβ单抗博鳌乐城获批。卫材与渤健联合开发的Aβ单抗Lecanemab(商品名:Leqembi)获得海南省药监局批准,落地海南博鳌乐城国际医疗旅游先行区,临床应用于早期阿尔茨海默病(AD)的治疗。在Ⅲ期临床中,与安慰剂相比,仑卡奈单抗治疗在18个月时减少患者CDR-SB评分的临床下降27%,淀粉样蛋白沉积水平降低约70%。今年2月,该新药已被CDE纳入优先审评。
3.信达VEGF/C3补体双抗上眼科III期临床。信达生物重组人血管内皮生长因子受体(VEGFR)-抗体-人补体受体1 (CR1) 融合蛋白efdamrofusp alfa注射液(IBI302)在治疗新生血管性年龄相关性黄斑变性(nAMD)的III期临床STAR完成首例患者给药。该项试验旨在评估玻璃体腔注射8mg IBI302与2mg阿柏西普(VEGF抑制剂)相比的疗效和安全性,主要研究者由上海市第一人民医院主任医师孙晓东教授担任。
4.辉大RNA编辑疗法获儿科罕见病资格。FDA授予辉大基因开发的全新RNA编辑疗法HG204儿科罕见病资格认定(RPDD),用于治疗儿童神经发育障碍疾病——甲基化CpG结合蛋白-2(MeCP2)重复综合征(MDS)。HG204 (AAV-hfCas13Y-gMECP2) 由单个腺相关病毒(AAV)载体递送新型高保真RNA编辑器hfCas13Y及靶向MECP2基因的gRNA,已在临床前MDS小鼠模型中显示出显著降低MeCP2 mRNA和蛋白表达水平,并逆转其疾病特征。
5.信达GPRC5D/BCMA/CD3三抗启动Ⅰ/Ⅱ期临床。信达生物GPRC5D/BCMA/CD3三抗IBI3003在Clinicaltrials.gov网站上注册启动一项Ⅰ/Ⅱ期临床试验,拟评估用于治疗晚期多发性骨髓瘤患者的安全性与有效性。该项研究预计2026年初步完成。研究发现65%的多发性骨髓瘤患者GPRC5D有超过50%的表达阈值。IBI3003采用了罗氏引进的CrossFab双抗技术,重链之间则引入Knob-into-hole技术,是全球首款进入临床的 GPRC5D/BCMA/CD3三抗。
国际药讯
1.辉瑞组合疗法获批BRAF V600E突变NSCLC。FDA批准辉瑞口服小分子BRAF激酶抑制剂联合MEK激酶抑制剂binimetinib(Mektovi)用于治疗BRAF V600E突变的转移性非小细胞肺癌(NSCLC)患者。在II期PHAROS研究中,联合治疗用于初治患者达到客观缓解率(ORR)为75%;用于经治患者的ORR为46%。此前,该组合方案已获FDA批准用于治疗BRAF V600E或V600K突变的不可切除或转移性黑色素瘤。
2.礼来GLP-1R/GIPR激动剂减重Ⅲ期临床积极。礼来GLP-1R/GIPR双靶点激动剂Tirzepatide治疗超重或肥胖患者的Ⅲ期临床SURMOUNT-3完整结果将发表于《Nature Medicine》和《ObesityWeek》上。与安慰剂相比,Tirzepatide展现优异的减重效果,接受Tirzepatide治疗的患者体重平均减轻21.1%;在84周(72+12周干预后),接受Tirzepatide治疗的患者体重平均减轻26.6%,而安慰剂组84周总平均减重3.8%。Tirzepatide总体安全性与SURMOUNT和SURPASS试验相似。
3.精神分裂症创新疗法Ⅱ期临床积极。Newron公司口服新化学实体--谷氨酸调节和电压门控钠离子通道阻断剂evenamide,在用于辅助治疗难治性精神分裂症(TRS)患者的Ⅱ期临床study 014/015最新数据积极。治疗6个月后,患者阳性和阴性综合征量表(PANSS)、疾病严重程度-临床疗效总评量表(CGI-S)以及Strauss Carpenter功能水平(LOF)较基线显著改善(p<0.001);药物耐受性良好,没有出现中枢神经系统异常的情况。
4.HSP90抑制剂化脓性汗腺炎Ⅱ期临床积极。MC2 Therapeutics新型HSP90抑制剂MC2-32(RGRN-305)治疗化脓性汗腺炎(HS)的Ⅱa期临床达到主要终点。与安慰剂相比,MC2-32治疗组第16周时脓肿和炎性结节减少至少50%的患者比例更高(60%vs20%);达到包括IHS4、HS-PGA、DLQI和NRS疼痛评分改善的患者比例也更高。MC2-32的耐受性良好,患者血液生化指标未出现明显的临床变化。
5.Alvotech公司乌司奴单抗生物类似药上市遭拒。Alvotech公司乌司奴单抗生物类似药AVT04的生物制品许可申请(BLA)收到FDA完整回复函(CRL)。FDA要求该公司解决其位于冰岛的雷克雅未克(Reykjavik )工厂的缺陷后,方可作出批准决定。乌司奴单抗是强生原研的一款IL-12/IL-23抑制剂,商品名为Stelara,已获批的适应症包括溃疡性结肠炎、克罗恩病、斑块状银屑病和银屑病关节炎。
6.Astria联合Ichnos开发长效OX40抑制剂。Astria公司与Ichnos Sciences就后者一款临床前期OX40拮抗剂STAR-0310达成全球独家许可协议,联合开发STAR-0310用于治疗特应性皮炎(AD),以及其他过敏反应和免疫疾病。STAR-0310结合了半衰期延长技术,旨在通过靶向OX40参与AD病理的多种T细胞,有望为患者提供长效治疗潜力。根据协议,Ichnos Sciences将获得1500万美元前期付款,高达3.05亿美元的里程碑后期付款。
医药热点
1.国家卫健委职责调整。10月13日,中国政府网发布《中共中央办公厅 国务院办公厅关于调整国家卫生健康委员会职责机构编制的通知》。根据《通知》,此次国家卫健委职责、机构、编制调整如下:将科技部的组织拟订科技促进卫生健康发展规划和政策职责划入国家卫健委;将国家卫健委的组织拟订并协调落实应对人口老龄化政策措施、承担全国老龄工作委员会的具体工作等职责划入民政部;国家卫健委代管的中国老龄协会改由民政部代管;将科技部4名行政编制、1名司局级领导职数划入国家卫健委;将国家卫健3名行政编制划入民政部。调整后,国家卫健委内设机构19个,机关行政编制444名,司局级领导职数81名。
2.北京市推出45个医务社工多元培育服务项目。为探索医务社工发展模式,扩大医务社工覆盖面,加快推动北京医务社会工作发展,北京市卫健委启动2023年北京市医务社工多元培育服务项目工作,按照安排,各医疗卫生机构结合单位特色,认真组织、精心策划、积极申报。经初筛、现场评审等环节,最终确定45个医务社工多元培育服务项目。截至目前,全市开展医务社会工作的医疗卫生机构101家,其中,三级医疗机构54家,较2019年增长184%;全市共有医务社会工作者306人,其中三级医疗机构194人,较2019年增长131%。
3.9月新增报告305例猴痘确诊病例。据中国疾控中心官网消息,2023年9月1日-30日,中国内地新增报告305例猴痘确诊病例,无重症、死亡病例。流行病学调查分析显示,99%病例为男性,92.9%病例明确为男男性行为人群,病例中有2例女性;性接触以外的其他接触方式传播风险低;94.3%为主动就诊发现,3.9%为密切接触者追踪筛查发现,其他为主动报告和入境筛查等发现;绝大多数病例主要为发热、疱疹、淋巴结肿大等症状。
评审动态
1. CDE新药受理情况(10月16日)
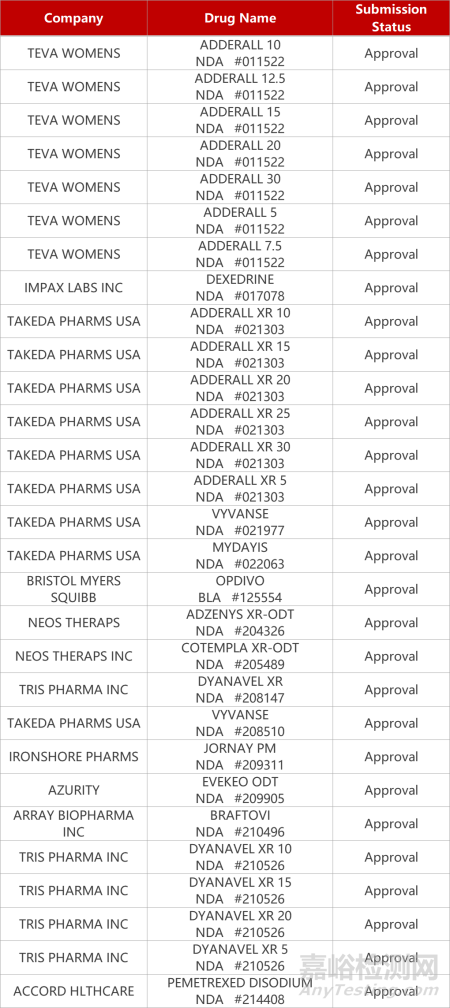
2. FDA新药获批情况(北美10月13日)