基本性能这个定义最早是在 IEC 60601-1-2 :2001 版的定义中出现,当时的定义为:performance characteristics necessary to maintain the residual risk within acceptable limits,这个定义当时引用的是还未更新出版的IEC60601-1 3.0 版 (npreparation )。
国内 GB 9706.1-2020 新标实施后,对于有源产品的基本性能有了明确的要求,尤其是在产品的送检阶段,需要制造商对自身产品的基本性能进行识别,但如何识别基本性能,还困扰着许多人。
以下分享以下关于基本性能的见解:
一、什么是基本性能
GB9706.1-2020 标准中定义,基本性能是与基本安全不相关的临床功能的性能,其丧失或降低到超过制造商规定的限值会导致不可接受的风险。
基本性能不是简单的性能或者功能的概念,其定义已经延伸到安全的理念引入了风险管理。简单来说就是产品的某一个临床功能,而不是超温、漏电流机械防护等安全指标,而是一个具体的临床功能指标。
例如:报警系统的不正确或者缺失报警信号,会导致医护人员不正确的响应,给患者带来不可接受的风险(死亡),这是属于基本性能丧失或降低会导致不可接受的风险;而用于诊断的 ME 设备诊断信息的结果正确性,如果给出不正确的信息会导致不适宜的治疗方法,给患者带来不可接受的风险。
当然,并不是所有信息的准确性是属于基本性能。如非重要的生理功能:记录的格式,显示,通信协议等;频率响应、申气噪声水平,数据处理能力的性能;这些不会给患者带来不可接受的风险,便不属于基本性能。
二、基本性能的几个特点
1) 基本性能是产品临床性能的功能
2) 基本性能不同于产品的基本安全,如电能、辐射能等等
3)一个医疗器械可以有很多的产品性能或功能,但并不是所有性能(功能)都是基本性能,如果缺失或超限值,引起不可接受的风险,才能是基本性能
4) 基本性能需要有限值规定,如果超限值,引起不可接受的风险
5) 不可接受的风险是制造商按照风险控制程序进行评估的
6) 基本性能不是所有有源产品都具有,对于某些类型的有源医疗器械可以没有基本性能
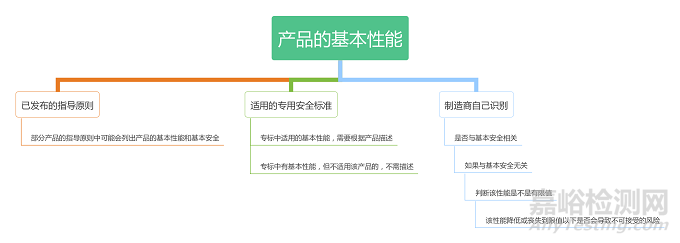
三、如何进行基本性能的识别
基本性能的识别主要有三人途径:
1) 通过产品发布的指导原则或同类产品的指导原则确定产品的基本性能
有些产品的指导原则可能会明确产品具有哪些基本性能,例如《强脉冲光治疗设备注册审查指导原则》(2022 年修订版) 的指导原则中明确说明产品的终端输出能量(能量密度) 和无非预期的输出是属于产品的基本性能。
2)产品的专用安全标准中规定的基本性能
对于具有专用安全标准的医疗器械,制造商需要查看专用安全标准中是否规定了基本性能,若专用安全标准中对该类设备规定了基本性能,则制造商认定的基本性能至少应包括专用安全标准中规定的基本性能。
除了专用安全标准之外,对于一些适用的国家通用标准或行业通用标准,可能也会涉及一些基本性能。
3) 制造商自己识别的基本性能
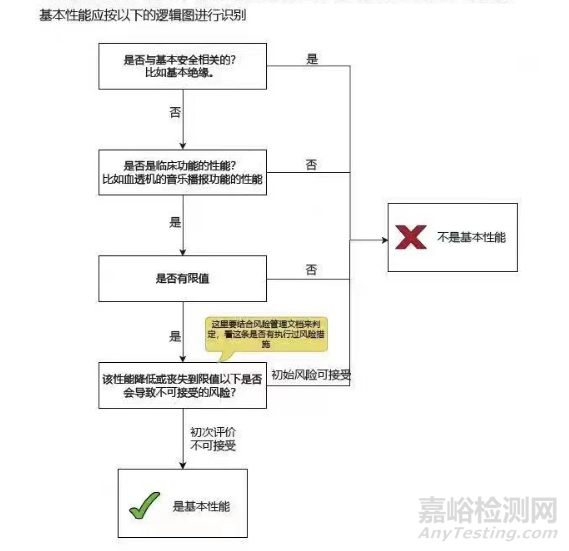
对于一些产品,可能没有对应的指导原则及专用标准,这一类产品的基本性能,主要还是需要靠制造商自己识别基本性能,判断的流程大致如下所示:
A.是不是与基本安全相关的,如果是,比如基本绝缘,不用往下走,一定不是基本性能;
B.如果与基本安全无关,继续执行本条,判断是否是临床功能的性能,如果不是,比如.上面提到的血透机的音乐播报功能的性能,不用往下走,一定不是基本性能,如果是,执行 C;
C.判断该性能是不是有限值: 如果没有,一定不是基本性能,如果有限值执行 D;
D.该性能降低或丧失到跟值以下是否会导致不可接受的风险,这里就要结合上面已经制定的风险可接受准则进行判定,如果风险依然可接受,就不是基本性能,反之,该性能就判定为基本性能。
总结
新版 GB9706.1-2020 标准最大的革新也就是引入了风险分析,对于医疗器械而言,需要从风险的角度识别基本性能并作为风险控制的输入;基本性能的判定也与风险分析密不可分,制造商应运用风险管理的思路尽可能识别所有风险,实施控制措施,保证产品安全。
当然,对于一些没有适用的指导原则、专用安全标准或通用标准中有规定的基本性能,制造商通过风险管理过程的识别也没有判定产品具有基本性能,可以定义该产品没有基本性能。