小容量注射剂属于高风险类药品,在实际生产中存在对质量影响较大的共线生产情况。为降低多品种小容量注射剂共线生产的风险,本文使用潜在失效模式与影响分析(FMEA)工具,从小容量注射剂的产品特性、工艺流程和共用厂房设施、设备及工器具等方面分析多品种共线生产时可能存在的风险,以 2 种最终灭菌小容量注射剂的共线生产为例,识别其共线生产中的风险点并进行评价和控制。对于多品种小容量注射剂共线生产的风险控制,不仅需要依靠严格的清洁验证,还需要优化设计并加强日常监控,才能更好地降低共线生产中的污染及交叉污染风险。
对于药品生产企业来说,为了合理利用资源,节约成本以及优化管理,会考虑将另一产品引入到合适的生产线生产,也就出现了共线生产的情况。但共线生产在降低成本的同时也带来了更大的质量风险。中国《药品生产质量管理规范(GMP)》(2010年修订) 第46 条第( 一) 款指出,应当综合考虑药品的特性、工艺和预定用途等因素,确定厂房、生产设施和设备多产品共用的可行性,并有相应评估报告[ 1]。因此从法规规定来看,不同品种的产品阶段性共线生产是可以被接受的,但前提是做好全面的评估和有效的控制。
注射剂由于其给药途径的高风险性,质量要求相对于其他剂型更高,尤其是对无菌的要求非常严格,因此这也在一定程度上限制了小容量注射剂共线生产的情况,并对注射剂共线生产提出了更高的控制要求。
1、小容量注射剂产品共线生产概述
1.1小容量注射剂介绍
小容量注射剂俗称水针剂,容量一般不大于20 ml,常见规格有1、2、5、10 和20 ml。小容量注射剂按照包装形式可分为安瓿瓶小容量注射剂、西林瓶小容量注射剂、卡式小容量注射剂和塑料瓶小容量注射剂等;按照无菌工艺特点可分为最终灭菌小容量注射剂和非最终灭菌小容量注射剂。
1.2共线生产方式介绍
注射剂的共线生产不如固体制剂应用普遍和灵活,根据注射剂的产品特性和质量要求,注射剂产品共线生产多采用阶段性生产方式,即在共用生产区内,在一段时间内集中生产某一产品,再对相应的共用生产区、设施、设备、工器具等进行彻底清洁,然后更换生产另一种产品的方式。阶段性生产方式按照共用程度可分为3 种:一是共用同一生产设施和设备;二是共用设施,专用设备;三是共用设施,专用直接接触药品的设备和器具。具体应用哪种生产方式要根据共线产品的特性和风险评估的结果决定。
1.3共线生产的一般要求
一般进行共线生产的不同注射剂产品要符合以下3 个条件:一是剂型和包装形式相同,如安瓿瓶注射剂和西林瓶注射剂由于包装容器的处理和密封方式的差异而不能共线生产;二是生产工艺相同或相似,如非最终灭菌小容量注射剂和最终灭菌小容量注射剂因产品无菌保证的工艺不同而不宜共线生产;三是产品的品种特性相似或相近,且共线生产的产品之间不存在直接或间接的配伍禁忌,如中药注射剂与化药注射剂在共线生产前应考虑中药注射剂的相关成分( 包括微量成分) 与化药之间是否会发生反应。
2、小容量注射剂共线生产的质量风险管理
质量风险管理,是指在药品的整个生命周期中对产品质量进行风险评估、控制、沟通和审核的系统过程[ 2]。质量风险管理流程主要包括风险评估、风险控制、风险回顾3 个阶段,风险评估又包括风险识别、风险分析和风险评价3 项内容。对多品种小容量注射剂共线生产进行全面的质量风险管理,既是法规和药监部门检查的要求,又是实际生产中保障共线产品质量的重要手段。
多品种共线生产中主要存在两大风险因素,即混淆和交叉污染。混淆是指物料混淆或产品混淆;交叉污染是指上一产品的成分残留或与下一产品发生反应、分解而影响下一产品的质量[ 3]。其中,交叉污染是最主要的风险因素。共线生产中引起交叉污染的途径主要有3 种:空气传播、直接接触和人为差错。由阶段性生产特点可知,小容量注射剂共线生产的交叉污染最可能是通过接触产生。所以对于共用设施、设备、工器具及工作服等的清洁和清洁验证就显得尤为重要。
2.1风险识别
风险识别是进行质量风险管理的基础,应基于小容量注射剂共线生产的问题系统地利用各种信息和经验来辨识所存在的风险及风险的产生因素[ 4]。这些信息应至少包括以下3 点:一是共线产品的基本信息,包括共线生产的小容量注射剂各产品的特性信息、工艺信息,以及共用厂房、生产设施、设备和器具的信息;二是产品的控制标准,一般产品的控制指标是确定的,在进行风险识别时可以按照需要控制的指标进行倒推,找出影响这些指标的因素,进而识别出风险;三是历史数据,在产品生产历史过程中经常造成项目出现偏差的影响因素可以确定为有风险。
本文主要依据共线产品的基本信息,即产品特性、生产工艺和共用厂房、设施、设备及工器具的信息对小容量注射剂产品共线生产的风险因素进行识别。
2.2风险分析
2.2.1 共线产品特性的风险分析
共线生产的注射剂产品应有相似或相近的产品特性,应对具体的产品特性进行分析,包括毒性、致敏性、活性、溶解度、性状和配伍禁忌或相互反应等,以确定多品种共线生产的可行性。
2.2.2 共线产品生产工艺的风险分析
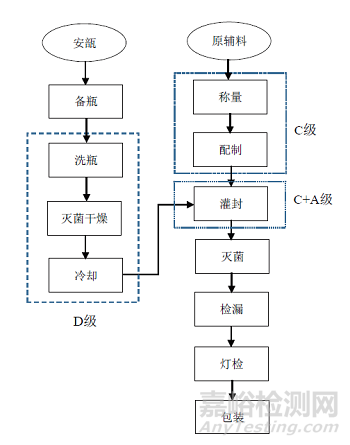
以多品种最终灭菌小容量安瓿瓶注射剂产品共线生产为例,其主要工序包括:安瓿的清洗灭菌干燥、原辅料称量、配制、灌封、灭菌、灯检和包装,生产工艺流程如图1 所示。
图1 最终灭菌小容量注射剂的一般工艺流程
对共线产品的生产工艺流程进行分析,从每一道工序的生产过程去考虑可能发生混淆和交叉污染的风险点。可以分别从人、机、料、法、环五方面去考虑每道工序的风险点,以防遗漏。重点分析其中的关键生产工艺是否受共线生产的另一产品干扰,最终灭菌小容量注射剂的关键生产工艺包括配制、灌封和灭菌。
2.2.3 共用厂房、设施、设备及工器具的风险分析
2.2.3.1 共用厂房
小容量注射剂生产车间的每个操作工序,均设有独立的操作间。不同品种产品使用不同的物料生产,如果上一品种的某个工序生产结束后,工作区域清场不彻底,上一品种物料遗留在操作间或操作间墙壁等位置,就有发生混淆、污染及交叉污染的风险。
2.2.3.2 共用设施
空调净化系统可以使洁净室内的温度、湿度、洁净级别及压差达到所需状态[5]。在共线生产中,空调净化系统处理不当极易引起污染和交叉污染,应重点对新风、回风、排风系统及布局进行风险分析,确保送风质量。
2.2.3.3 共用设备及工器具
在最终灭菌小容量注射剂产品的生产工序中,洗瓶、配制、灌封、灭菌等环节的设备在生产过程中共用。如果这些设备在上一品种产品生产结束后清洁不彻底,会对下一品种产生污染风险。
除了部分设备共用,原辅料称量、配制、过滤和灌装工序的操作中所涉及的一些工器具也会共用,如物料桶、投料漏斗、镊子等。如果这些工器具在上一品种产品生产结束后清洁不彻底,也会对下一品种产生污染风险。
2.3风险评价
2.3.1 风险评估工具
表1 FMEA 严重性评估参考标准
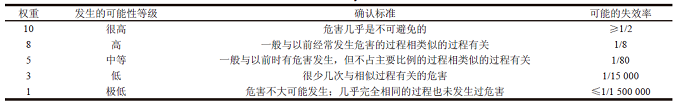
表2 FMEA 可能性评估参考标准
表3 FMEA 可检测性评分标准
本文采用潜在失效模式与影响分析(FMEA) 风险评估工具。FMEA 法是目前生产企业开展风险管理工作常用的风险评估工具,也是ICH Q9 推荐的风险评估工具之一。FMEA 法认为每一个潜在失效模式的风险程度可以从风险的严重性(S)、可能性(O)、可检测性(D) 三方面进行量化,风险程度的大小用风险系数(risk priority number,RPN) 来表示,计算方法为:RPN=S×O×D。评分模式根据具体的风险评估对象可以有很多种,本文对于小容量注射剂共线生产采用的是如下评分方法。严重性、可能性、可检测性的评分标准分别如表1、2、3 所示。再根据RPN 来划分风险等级,见表4。
表 4 风险等级划分
2.3.2 风险评估表
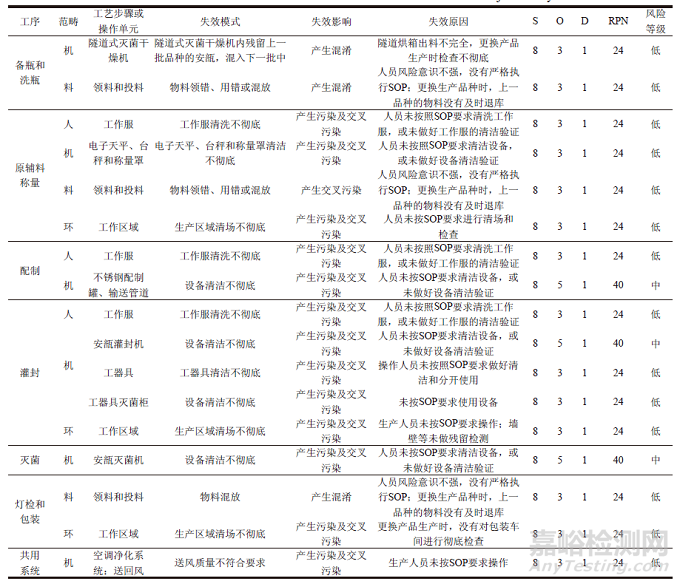
根据以上风险分析,以小容量注射剂某生产车间共线生产A和B 2 种最终灭菌小容量注射剂为例,照图1 所示的工艺流程,对每一生产工序对应的操作单元分析其在共线生产中可能的失效模式,以及失效影响和原因,发现的风险问题如表5 所示。
表5 最终灭菌小容量注射产品共线生产各工序的风险评估结果
2.4风险控制
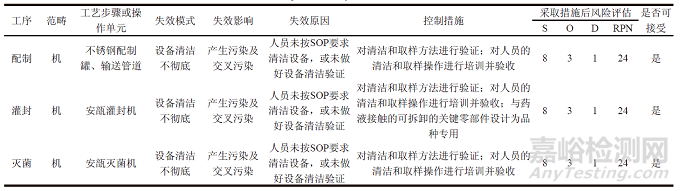
对于以上风险评估表中风险等级为中高的风险点,制定必要的风险控制措施,降低风险发生的可能性或提高风险的可检测性,并在措施实施后重新进行风险评估,确保残余风险降低到可接受范围内。另外对于采取的风险控制措施应进行必要的文件标准化,使制定的风险控制措施落实到位。采取控制措施后的风险评估结果如表6 所示。
表6 最终灭菌小容量注射产品共线生产采取措施后的风险评估结果
2.4.1 清洁验证
最终灭菌小容量注射剂的生产工序中,安瓿的清洗灭菌干燥、原辅料称量、配制、灌封、灭菌、灯检和包装等环节的设备在生产过程均需要共用。共用设备如果清洁不彻底,则都存在着污染及交叉污染的风险。由风险评估表可知,配制、灌封和灭菌是风险较高的三道工序。应对相应工序中共用的关键设备( 如不锈钢配液系统、安瓿灌装封口机、安瓿灭菌机),尤其是直接接触物料的设备部位做好清洁验证。清洁验证之前应先确定标记物,标记物应综合考虑清洁的难易程度和活性物质的药理作用,通过风险评估来确定,一般选择产品中溶解度小、毒性或致敏性强的成分作为清洁标记物,并通过计算制定标记物的残留标准。此外,还应根据每台设备的构造和作用确定其取样方式和取样点。取样方式应能准确、有效地获取可能存在的残留物质;取样点应具有代表性,不仅应包括如投料口等设备的关键部位,还应包括设备上最难清洁的部位。
在小容量注射剂的共线生产中,每次更换品种前,都应对共用设备进行残留物质的清洁验证,由于注射剂产品对微生物的要求非常高,还应对设备进行微生物的清洁验证。必要时,还应对清洁方法进行验证。
2.4.2 优化设计
在小容量注射剂共线生产的过程中,清洁验证固然重要,但对于某些对产品质量有重要影响的工器具及设备零部件来讲,更好的解决办法是专用。如配置所用的物料桶、投料漏斗,过滤所用的滤芯,灌装所用的灌针、分液管等都应在更换生产品种时一并更换掉。又如空调净化系统的初效、中效、高效过滤器和回风的粗滤等,这些有可能产生物料富集的设备零件在更换生产品种前也一并进行更换。此外,生产不同产品所用的洁净服也可设置为品种专用,或使用专用洗衣机进行清洗。这些在共线生产中的专用设计并不会增加过多的生产成本,但却能大大降低生产过程中污染及交叉污染的风险,对于确保产品质量有重要作用。
由表6 可知,采取风险控制措施后,配制、灌封和灭菌工序中用到的不锈钢配制罐或输送管道、安瓿灌封机、安瓿灭菌机等关键设备清洁不彻底的问题均由中风险降至低风险。
2.5风险回顾
完成风险评估后,应定期对风险管理过程的结果进行回顾,回顾频率应适应相应的风险水平。应建立定期的风险审查机制,分析一年来的产品各项指标控制情况,总结偏差特点和趋势,建立风险降低的改进计划[ 6]。此外,企业还应该在以下情况发生时,对风险进行再评价:1) 原辅料、直接接触药品的包装材料、质量标准、检验方法、操作规程、厂房、设施、设备、仪器、生产工艺、计算机软件等发生变更时;2) 当法律法规及技术要求发生变更时;3) 当企业的管理层、客户提出对质量管理更高的要求时。
3、结语
多品种小容量注射剂共线生产的风险评估应综合利用各种信息和经验,至少从产品特性、工艺流程和共用厂房设施、设备及工器具三方面进行分析。通过风险评估,发现共线生产中可能发生交叉污染和混淆的风险点,再有针对性地提出降低风险的措施并落实。鉴于注射剂多采用阶段性共线生产的方式,在风险控制措施中不仅要依靠清洁验证发挥重要作用,还应认真考虑在共线生产所涉及的设施、设备及工器具中共用与专用的合理性,并加强日常监控,从而最大程度地降低小容量注射剂共线生产时产生交叉污染和混淆的风险,保障产品质量。
参考文献
[1] 国家食品药品监督管理总局.卫生部令第79号 药品生产质量管理规范[S].北京: 卫生部, 2011.
[2] ICH. CHQ9: Quality risk management [EB/OL].[2020-03-28].
[3] 陈青青.浅谈产品共线生产的风险控制和交叉污染防控[J].机电信息, 2018, (8): 47-49.
[4] 梁 毅.GMP教程[M].3版, 北京: 中国医药科技出版社,2015: 23-24.
[5] 毛述春.无菌粉针剂产品共线生产的风险评估与分析[J].机电信息, 2017, (14): 1-4.
[6] 梁 毅, 黄 雪.基于固体制剂生产工艺的质量风险管理研究[J].中国药房, 2016, 27(13): 1733-1736.