OOS/OOT调查在日常研发和QC中遇到的可能性很大,对此FDA等有指导原则,国内的企业也多数参考其制定了适合本身使用的内部规程来指导和规范调查。一般要求调查时要进行书面记录,以“偏差调查/CAPA”的形式记录事件的发生情况、调查过程、产生原因、CAPA。犹如警察断案一般,非常考验调查人员的经验和分析能力,对萌新更是一个不小的挑战。本文展示实际研发中的调查实例,大家开展调查和撰写调查报告提供参考,个家之言难免有所疏漏,敬请指正。
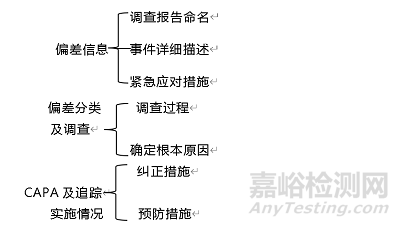
调查报告应至少包括以下关键点(包括并不限于):
1. 偏差信息
偏差信息通常包括:调查报告命名、事件详细描述和紧急应对措施。
1.1. 调查报告命名
主要是把事件进行概括,便于存档和随时调阅,查阅的人能够立即知道事件的概要。要包括发生OOS产品的名称、批号、涉及到的检验项目,如为稳定性,还要包括考察条件和检测时间点。
举例:
泊沙康唑肠溶片(品名)123456批(批号)稳定性试验中间条件6个月(考察条件和时间)有关物质(涉及到的检验项目)调查报告。
1.2.事件描述
主要是要描述清楚什么人在什么时候、干了什么、发现了什么(具体到序列名称、序列中包含了什么等),结果是什么?判定标准等,无论是上报还是书写调查报告均需要描写清楚。如有必要需写清楚发生地点:要有识别性和唯一性,增加房间编号,如F13溶出室。
举例:
2023年03月07日(时间),质量研究部(地点)王小二(人物)在检测XXXX(产品)有关物质定量限(检验项目)时发现:杂质E的信噪比8.3(检验结果要数字化)不符合标准规定,标准规定为≥10(必须写清楚标准规定)。如果数据较多,请用“表格”来表达,清晰、美观、容易分辨。
1.3.紧急处理措施
主要是为了停止偏差继续产生的影响,一些常用的措施有:停止液相序列进行、封存样品、封存所用试剂试液等。
2. 偏差分类及调查
偏差分类及调查顾名思义主要是指调查的过程及最终确定偏差发生的根本原因。
2.1.调查过程
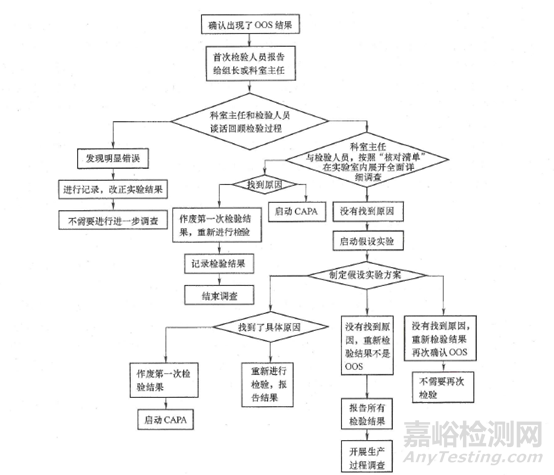
调查的核心目的是通过对实验室进行本次检验的各个环节(人、机、料、法、环等)进行详细的检查,以期发现实验室质量管理体系方面的缺陷,找出原因,进一步提高实验室质量管理水平和检验检测能力,保证检验结果的准确可靠。2019版中国药品检验标准操作规范中对OOS的调查过程也进行了详细的描述。
图1调查流程图
实验室一般从离异常/OOS/OOT结果或异常现象最近的步骤开始调查(积分、计算、灌注、滤过、定容、稀释、移液、溶解、崩解、称量、取样等等)。而且,在确认所有的试验操作均与SOP保持一致的基础上,检验人员一定要仔细回顾溶液制备时间、可疑的所有环节、操作和检验过程中的现象如:是否溶液颜色异常?浑浊?沉淀?絮状物?溶出度的取样体积是否正常?等等。温度也是一个值得注意却常常被忽视的影响因素,当天实验室温度如何,有没有最近温度骤降或升温导致的室内温度变化?
2.2.确定根本原因
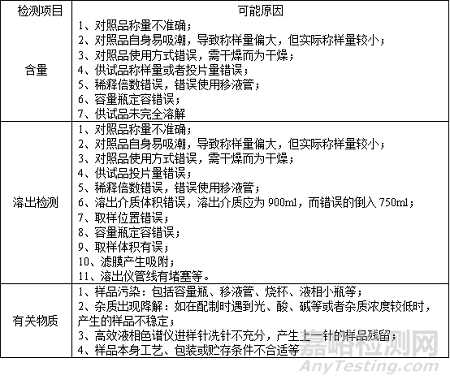
确定根本原因一般是在考虑多种可能原因后,经过调查试验,最终得出的产生偏差的最根本的原因。以图表呈现更加清晰简洁,
对于各个环节可能出现的问题进行合理的假设并进行重复检测,通过调查最终确定其偏差发生的根本原因。为此,对可能产生偏差的环节及其原因进行了归纳总结,如下表:
3. CAPA及追踪实施情况
CAPA及追踪实施情况主要包含两个部分:一是确定根本原因后的纠正措施;而是确定根本原因后的预防措施。
3.1.纠正措施
纠正措施是纠正确定产生偏差的根本原因后,重新进行的样品或方法检测。
例如:在某某项目,含量分析方法的方法转移试验中,所测含量超出95%~105%限度的根本原因为二步稀释时移液管使用错误。对此的纠正措施为:更换正确的移液管后重新配制样品重新进行含量分析方法的方法转移。
3.2.预防措施
是在确定偏差产生的根本原因后,针对此原因制定的预防后期产生相同偏差的措施。制定有针对性的预防措施,才能预防同样事件重复发生,减少重复试验,从而提高工作效率。并且制定的预防措施,如果能加入SOP的一定加入SOP,不能靠人传人或者口头培训。对于操作性的SOP,一定要细化并进行详细的培训。防止不同人员理解不同,导致误操作。
例如:在某某项目的有关物质定量限检测中发现某一杂质的峰面积低于该杂质理论定量限溶液峰面积的10倍,后经过调查发现其根本原因为,该杂质在定量限浓度及其更低浓度时,在溶剂中不稳定,易降解。故针对此原因制定的预防措施为,将“定量限溶液临用新制和进样盘控温4℃”定入SOP并在培训时着重强调此项注意事宜。
不管是纠正措施还是预防措施都必须要有一定的时限性,且责任明确并设定人员跟踪确认完成情况。
参考文献:
[1]FDA: Investigating Out-of-Specification (OOS) Test Results for Pharmaceutical Production
[2]中国药品检验操作规范2019年版-异常检验结果调查指导原则