您当前的位置:检测资讯 > 行业研究
嘉峪检测网 2023-03-14 08:48
摘要
目的:了解我国实行药物临床试验机构备案制后,药物临床试验机构的现状。
方法:通过药物临床试验机构备案管理信息平台和药物临床试验登记与信息公示平台对我国药物临床试验机构数量和类型、地域分布、备案专业、主要研究者(PI)及承担临床试验数量等情况进行统计分析,检索时间为2019年12月1日至2022年4月13日。结果截至2022年4月13日,已有1185家临床试验机构在备案平台完成备案,其中医疗机构1169家(98.65%),疾病预防控中心16家(1.35%)。较资格认定时期,机构增加了299家,增长率为33.74%。临床试验机构仍主要集中在我国东部地区,以广东、江苏、山东省最多。备案机构数位于前三的专业分别为肿瘤(695家)、心血管内科(619家)和呼吸内科(571家),其中肿瘤专业拥有PI人数最多(3717人),其次为中医科(1881人)。
结论:备案制实行后,增加了部分医疗资源供给,一定程度缓解了药物临床试验市场旺盛的需求;但仍存在机构数量地域分布差异、PI资源及承担临床试验数量分布不均衡等问题。
关键词
临床试验;组织和管理;研究人员;机构备案
正文
药物临床试验是药物创新产业的关键环节,是评价试验用药品人体内安全性和有效性的唯一方法,其实施主体是药物临床试验机构(以下简称“机构”)。近年来,随着我国医药产业创新能力的不断提高以及仿制药一致性评价的开展,越来越多的药物进入临床试验阶段,研究资源呈现出紧张形势,包括机构数量较少、现有机构承载能力和研究水平有限等。资源供需矛盾日益凸显,成为制约我国新药创新的巨大瓶颈。
为进一步释放临床试验资源,打破因机构相对紧缺造成对我国药品创新发展制约的现状。2017年10月,中共中央办公厅、国务院办公厅发布《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号,以下简称“两办意见”),正式提出临床试验机构资格认定实行备案管理。同年,为进一步落实两办意见,做好机构资格认定调整为备案管理的相关准备工作,国家药品监督管理局(以下简称“国家药监局”)发布《药物临床试验机构管理规定(征求意见稿)》。经过两年的意见征集,最终于2019年11月29日,国家药监局联合国家卫健委发布《药物临床试验机构管理规定》(以下简称“机构管理规定”),宣布自2019年12月1日起,机构由资格认定调整为备案管理,相关机构和单位需登录“药物临床试验机构备案管理信息平台”(以下简称“备案平台”)进行备案,并要求自2020年12月1日起,申办方应当选取已备案的机构开展药物临床试验。医疗机构和疾病控制中心只有在完成备案后方可开展临床试验。
备案管理相较于资格认定在申请流程以及所需时间上有了极大的简化。原资格认定时期,机构从向省级卫生部门提交申请材料,到最后拿到国家药监局颁发的资格认定证书,在材料齐备的情况下所需法定办结时间大约为120个工作日(近6个月)。而备案管理制下,机构只需在“备案平台”上注册并提交材料,由国家药监局进行审核通过后,“备案平台”将在线自动生成备案号。
本研究将利用备案平台,汇总备案机构数量和类型、地域分布、备案专业与主要研究者(PI)等信息,了解备案管理制实施以来机构备案具体状况,并结合药物临床试验登记与信息公示平台(以下简称“CDE公示平台”)发布的临床试验数据,简要分析我国临床试验资源分配现状。
资料与方法
资料来源:
所有数据来源于备案平台和CDE公示平台。检索时间为2019年12月1日至2022年4月13日。
研究方法和数据收集:
检索备案平台发布的机构信息和CDE公示平台公示的临床试验项目数据,对机构数量及类型、地域分布、承接临床试验项目数量、备案专业及主要研究者进行统计分析。所有数据采用Microsoft Excel软件进行统计处理。
结果
备案机构数量及类型情况:
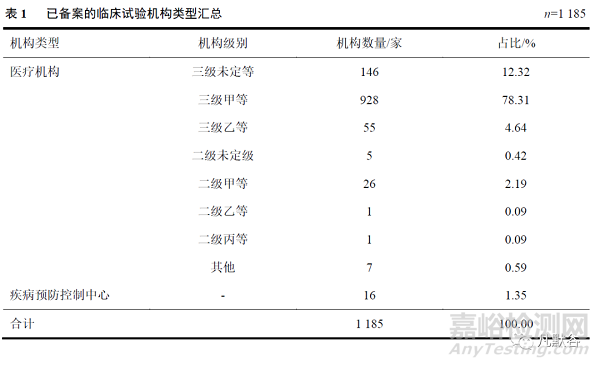
截至2022年4月13日,备案平台中显示已备案的机构共1185家,与备案制实施前已获得“资格认定”的886家机构数相比,增加了299家,增长率为33.74%。在已备案机构中,三级医院数最多,共计1129家(占95.27%),二级医院33家(占2.78%),其他医疗机构7家(占0.59%)。此外,还有省级疾病预防控制中心16家(占1.35%),主要从事疫苗的临床试验,其中在2020年4月我国新型冠状病毒(新冠)灭活疫苗首次进入I期临床试验前完成备案的疾控中心12家,占全部备案疾控中心总数的75.00%。见表1。
备案机构地域分布情况:
1185家机构分布于32个省级行政区。依据各省级行政区拥有的机构总数进行汇总排序,位于前10位的分别为广东、江苏、山东、河南、北京、浙江、上海、四川、湖北和湖南,数量均超过50家;而位于后5位的甘肃、中国香港、青海、宁夏和西藏,机构数量均不足10家,见图1。按照国家统计局东部、中部、西部三大经济区(不含港澳台)划分标准,对机构进行分区统计;其中,东部地区共计657家,占全部机构总数的55.44%,中部地区的326家(占27.51%),西部地区的198家(占16.71%)。
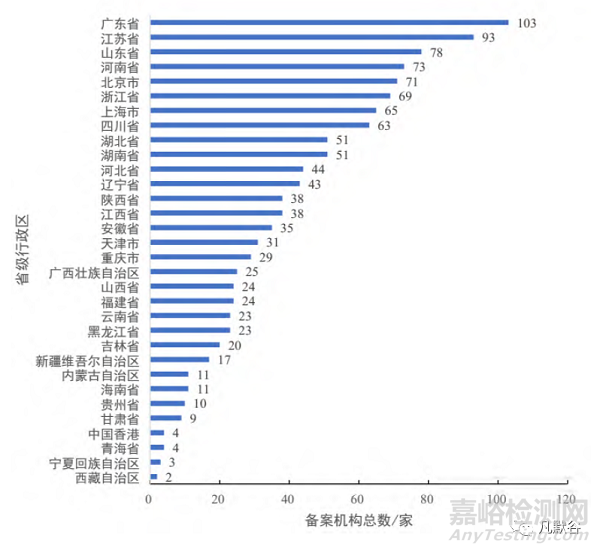
图1、各省级行政区已备案机构总数情况
备案机构承接临床试验情况:
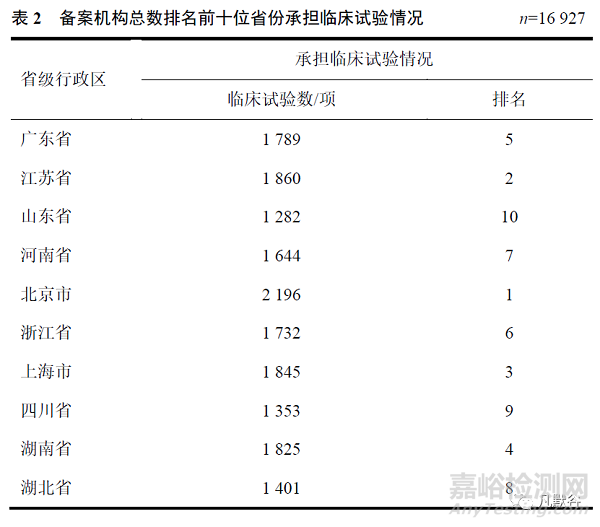
通过CDE公示平台对备案机构总数排名前10的省份登记的临床试验信息进行统计(同一省级行政区不同机构,参与同一项临床试验,按一项临床试验计数),除了江苏省与浙江省承担临床试验数量与备案机构数量排名一致外,其他各省承担的临床试验总数与备案机构总数并非呈正相关性。尤其是备案机构总数位于第1位的广东省(103家,1789项)和第3位的山东省(78家,1282项),其承担的临床试验数量远落后于备案机构总数排名第5位的北京市(73家,2196项)和第7位的上海市(65家,1845项),见表2。
备案专业及PI情况:
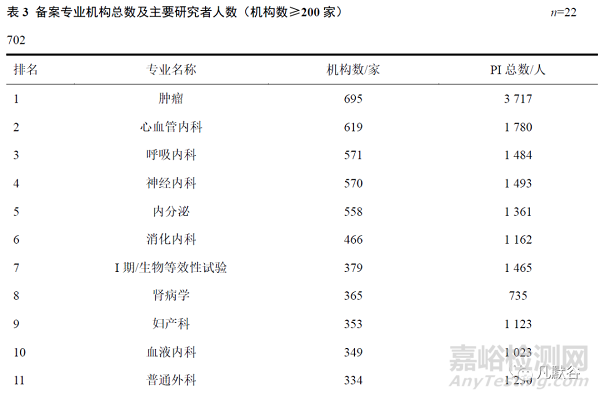
经统计,全国备案专业总数达29644个,拥有机构数量超过200家的备案专业共计19种,排名前10位的专业依次为肿瘤、心血管内科、呼吸内科、神经内科、内分泌、消化内科、I期/生物等效性试验(BE)、肾病、妇产科以及血液内科。其中,肿瘤与心血管内科专业的备案机构数量分别高达695家和619家,均已超过已备案机构总数(1185家)的50%。在完成备案的机构中,PI总数达26664人,其中肿瘤专业备案PI人数最多,达3717人,占13.94%,中医科与心血管内科分别以1881人与1780人位居第2和第3位。见表3。
3 讨论
截至2022年4月13日,备案平台上显示1185家机构处于已备案状态,较资格申请认定时期,机构增长率达33.74%。由此可见,备案制实施后,通过简化机构资格申请的流程,确实促进了更多医疗资源释放并为临床试验所用。三级医院依旧凭借更加完备的医疗条件和严谨的研究团队,成为机构备案的主力军。除了医疗机构之外,16家省级疾病预防控制中心也积极完成了机构备案,这对于疫苗临床试验的开展,尤其是对2019年新冠病毒疫情爆发后疫苗研发工作的顺利进行具有重要意义。
从地域分布来看,1185家已备案的机构中657家(占55.44%)均位于我国东部地区,仅有198家(占16.71%)位于西部地区,其中,广东、江苏和山东分别以103、93、78家机构居于前三,而青海、宁夏和西藏自治区机构总数均不超过5家,显示出我国各省间机构数差异较大,区域分布尚不均衡,更多集中在东部地区。主要原因还是与我国经济发展与医疗资源分配不平衡有关,东部地区各省份经济较为发达,卫生资源配置比较完善,相对于西部地区更易于建设机构。
从机构总数排名前10位的省份(含直辖市)承接的临床试验数量上看,除了江苏和浙江省之外,其它各省份备案机构总数与承担临床试验数量并非呈正相关性。其中北京、上海等一线城市依旧承担着较多的临床试验项目,远高于机构总数排名第1位的广东省和第3位的山东省。分析原因可能是申办者在选择机构时,更倾向于患者资源丰富和医疗实力较强的研究中心。北京、上海作为一线城市,不仅有优质的医疗资源、浓烈的学术科研氛围,更是凭借先进的医疗技术吸引全国各地的患者就诊,因此更易获得申办方的青睐,从而承接较多临床试验项目。
备案专业中肿瘤、心血管内科以及呼吸内科在备案机构数位列前三,其中肿瘤专业备案PI人数最多,其次是中医科。肿瘤之所以能成为备案专业机构数以及PI数最多的专业,与其高发病率、新药研发活跃、开展的临床试验项目数较多密切相关。据报道,2020年我国注册类肿瘤药物临床试验,占同期全部药物临床试验的28.30%,年增长率达52.30%。由此可预见,为满足肿瘤临床试验药物研发的需求,未来肿瘤专业备案机构以及PI人数可能仍将持续走高。而中医、中药作为祖国的瑰宝,是具有较高成长性的领域,近年来,随着围绕促进中医药发展相关政策的落地实施,各大中医院已逐渐重视中药临床试验的发展。虽然当下中医科由于我国中医院占比较少的客观原因未能进入备案专业机构数排名的前10位,但在不对其具体专业进行区分的前提下却也是拥有PI人数仅次于肿瘤的专业。
总体而言,机构备案制实施后,虽然各省份之间备案机构数量差异大,研究者资源以及临床试验承接能力不均衡的局面依旧存在。但确实增加了一部分医疗资源的供给,一定程度缓解药物临床试验市场旺盛的需求,对于促进医药创新产业的发展具有重要意义。但同时备案制带来的潜在风险可能也将对药物临床试验的质量产生一定的影响。一方面机构备案实行的是“宽进严出”的模式,监管部门在备案前不对机构的备案资料进行审核,后续日常监督检查和药品注册核查时才会检查机构的相应资质。若在备案前机构自身或聘请的第三方未能对其临床试验机构及专业的技术水平、设施条件等做出真实、准确、科学以及合理的评估,即上传材料,完成备案,同时又在首次监督检查前即开展药物临床试验,尤其是新建的备案机构,就很有可能会因为自我或第三方评估不到位,自身经验不足、管理制度及标准操作流程文件不完善等诸多潜在的风险因素影响药物临床试验的质量,甚至危害受试者的权益。另一方面,目前针对机构的日常监督检查,国家层面并未出台统一的检查管理办法及检查标准,主要由各省级的药监、卫生主管部门负责制定与实施,因而各省对机构日常监管制度也存在一定的差异。主要表现在:(1)监督检查频次不一。如四川省原则上是已备案机构一年安排一次日常监督检查;福建省是临床注册核查、专项检查、有因检查与日常监督检查相结合,两年内机构现场检查全覆盖;广东省则是每三年至少安排一次试验机构日常监督检查。(2)具体检查标准及检查结果判定上,不同省药监部门要求也不相同。如京津冀对机构日常监管中规定了30个检查环节、133个检查项目,其中关键项目18项,一般项目115项。若发现任何严重缺陷,或一般缺陷>20%的,检查结论即为不符合要求;相对而言,四川省的检查项目及标准则比较宽松,只设置了19个检查环节、57个检查项目。其中关键项目9项,一般项目14项,其他为抽查项。如出现一项严重缺陷,或一般缺陷≥30%,检查组向省药监局提出给予机构警告建议。长久以往,各省可能会因为监管领域上彼此之间尺度和力度不同,致使各区域机构的质量管理水平的差异不断拉大,最终可能影响临床试验的质量水平。
综上,机构备案制的实施,既为临床试验的发展带来了机遇,同时也提出了新的挑战。但相信随着相关政策法规的建立健全,临床研究体系的完善,以及国家及区域性临床研究中心的搭建等,终将推动我国机构临床研究水平的进一步提升和发展。
参考文献
详见《中国新药与临床杂志》2023年

来源:《中国新药与临床杂志》


