您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2023-03-08 22:47
摘要
目的:
建立缬沙坦片溶出度的测定方法。
方法:
以磷酸盐缓冲液(pH 值6.8)1 000 mL为溶出介质,转速为50 r·min-1,经30 min 时取样,采用紫外-可见分光光度法在250 nm 处测定吸光度,按外标法计算缬沙坦片的溶出度。通过耐用性、滤膜吸附实验、线性与范围、溶液稳定性、精密度试验、重复性试验、回收率试验等试验研究,对缬沙坦片的溶出方法进行验证。
结果:
该溶出方法学验证结果良好。缬沙坦溶液质量浓度在1.61~17.71 mg·L-1内线性关系良好,回归方程为Y=3.17×10-2x-0.6×10-3,r=0.999 9;方法的回收率、精密度、重复性符合要求,供试溶液在12 h 内稳定。
结论:
本方法能准确测定缬沙坦片的溶出度,控制缬沙坦片的质量。
关键词
药剂学;溶出度;浆法;紫外-可见分光光度法;缬沙坦片;验证
正文
缬沙坦是由瑞士诺华公司开发的降压药,口服药品包括40、80、160、320 mg 四种规格,缬沙坦是一种高选择性Ⅰ型血管紧张素Ⅱ受体(AT1 受体)拮抗剂,具有良好的抗高血压作用,其通过对肾素-血管紧张素-醛固酮系统(RAS)特异性阻断达到控制血压的效果,其降血压疗效和耐受性已在多个临床试验中得到证明[1-2]。
口服固体制剂的溶出行为的考察是评价药品质量的重要标准[3-4]。在仿制药研发中,溶出度试验为处方及工艺的开发提供方向,也是预测仿制药生物等效性的有效手段,还是评价药品质量稳定性的重要手段之一[5]。
由于缬沙坦在水中溶解度小,溶出是限制其体内吸收的主要过程,所以建立溶出度的测定方法,使其准确反映产品质量,有利于控制和提高缬沙坦仿制药质量,提升其体内生物等效性试验的成功率。
作者主要对160 mg 规格产品进行溶出度的方法学研究,评价产品的质量。
内容由凡默谷小编查阅文献选取,排版与编辑为原创。如转载,请尊重劳动成果,注明来源于凡默谷公众号。
1 仪器与材料
UV2300 紫外-可见分光光度计(上海天美科学仪器有限公司),RC8MD 溶出仪(天大天发科技有限公司),XSE205 电子天平、FE-20 pH 计(梅特勒-托利多仪器有限公司)。
缬沙坦片(规格160 mg,华北制药股份有限公司,批号XS1405001、XS1405002、ZS1405003),缬沙坦对照品,(中国药品生物制品检定所,批号100651-201203),缬沙坦参比制剂(规格160 mg,瑞士诺华制药有限公司,批号B8292YX)。
磷酸二氢钾、磷酸氢二钾、氢氧化钠(分析纯,北京化工厂),水为纯化水(华北制药股份有限公司)。
2 方法与结果
2.1 溶出度方法的确定
缬沙坦片收载于《中华人民共和国药典》2015 年版二部及《美国药典》USP39 版[6-9]中,两者规定的溶出度检测方法均为以磷酸盐缓冲液(pH 值6.8)1 000 mL 为溶出介质,转速为50 r·min-1,经30 min 时取样,照紫外分光光度法在250 nm 处测定吸光度,按外标法计算溶出度[8-9]。
可见,该方法为大家所公认,所以缬沙坦片的溶出度研究仍采用该方法。
2.1.1 溶出介质的制备
pH 值6.8 磷酸盐缓冲液:取磷酸二氢钾3.60 g 和磷酸氢二钾三水合物5.37 g,加水适量振摇使溶解,加水稀释至1 000 mL,摇匀,即得。
2.1.2 对照溶液的制备
取缬沙坦对照品适量,精密称定,加溶出介质溶解并制成每1 mL 中约含16 μg 的溶液。
2.1.3 供试溶液的制备
取溶出介质1 000 mL,置于溶出杯中,共6 杯。
设定温度为37 ℃,开启仪器。取供试品6 片,分别投入6 个溶出杯中,转速为50 r·min-1,启动仪器,计时,经30 min 取样,取样体积为5 mL,立即过滤,精密量取澄清滤液适量,用溶出介质稀释制成每1 mL 约含缬沙坦16 μg的溶液,即得。
2.1.4 测定方法
照紫外-可见分光光度法,在250 nm 处测定供试与对照溶液的吸光度,按照外标法以吸光度计算溶出度。
2.1.5 结果判定
计算每片的溶出量,限度为标示量的80%。
2.2 溶出度的检测方法研究
2.2.1 线性关系考察
取缬沙坦对照品约8 mg,置于250 mL 量瓶中,用pH 值6.8 磷酸盐缓冲液溶解并稀释至刻度,摇匀,作为对照储备液;精密量取对照品储备液1、2、4、6、8、10 和11 mL,分别置于20 mL量瓶中,加pH 值6.8 磷酸盐缓冲液稀释至刻度,摇匀,作为线性溶液。
缬沙坦溶液质量浓度在1.61~17.71 mg·L-1 内线性关系良好,回归方程为Y=3.17×10-2x-0.6×10-3,r=0.9999,Y 轴截距为100%响应值的0.012%,不大于2.0%,响应因子的RSD 值为1.8%,不大于2.0%,结果见表1。
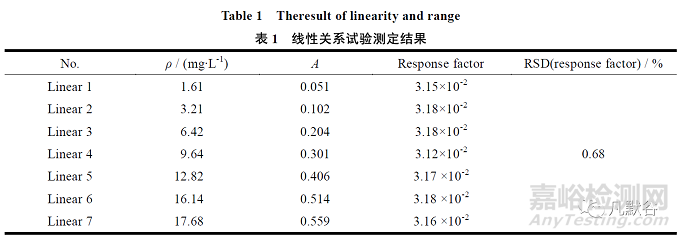
2.2.2 精密度试验
按“2.1.2”条配制1 份缬沙坦对照溶液,连续测定6 次,吸光度的相对标准偏差为0.11%,说明精密度良好,结果见表2。
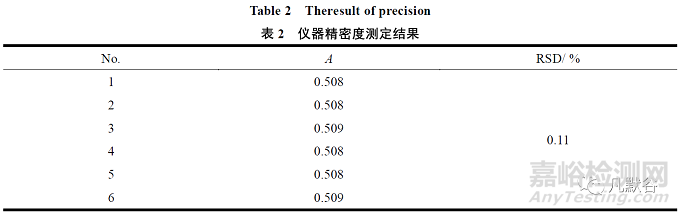
2.2.3 滤膜吸附试验
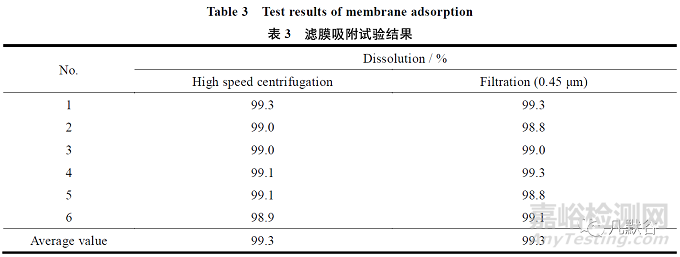
取溶出液适量,分别采用过滤和离心的方式进行处理后测定吸光度,计算溶出度。取溶出液适量,采用转速为4 000 r·min 离心5 min,取上清液用溶出介质稀释成每1 mL 约含缬沙坦16 μg的溶液,作为高速离心法制备溶液。
另取溶出液适量,经0.45 μm 滤膜滤过,取续滤液适量,用溶出介质稀释成每1 mL 约含缬沙坦16 μg 的溶液作为滤膜过滤液,照紫外-可见分光光度法,在250 nm 处测定供试溶液与对照溶液的吸光度。
过滤法和高速离心法结果基本一致,说明滤膜对本品无吸附,结果见表3。
2.2.4 回收率试验
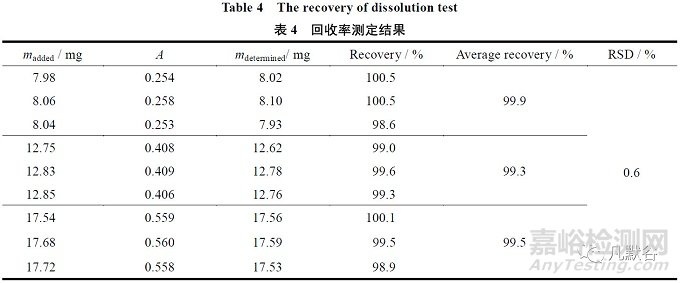
配制限度浓度(16 mg·L-1)的50%、80%和110%的供试溶液各3 份,分别测定其含量,将实测值与理论值比较,计算回收率。称取混合空白辅料16 mg,共9 份,分别置于1 000 mL 量瓶中,分成3 组,每组3 份,称取缬沙坦对照品约8.0、12.8 和17.6 mg 各3 份,精密称定,分别置上述1 000 mL 量瓶中,加pH 值6.8 磷酸盐缓冲液溶解,过滤。
照紫外-可见分光光度法,在250 nm处测定吸光度。本品平均回收率为99.6%,结果在98.0%~102.0%之间,9 个回收率数据的相对标准差(RSD)为0.6,小于2.0%,说明本法回收率良好,准确度高,结果见表4。
2.2.5 稳定性试验
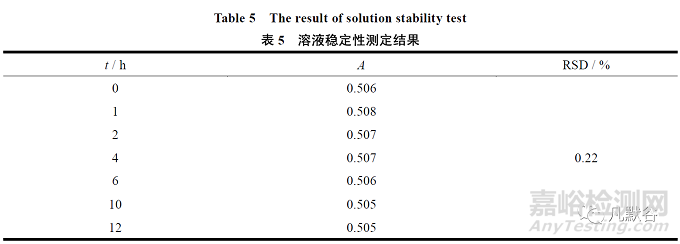
取供试品适量,以pH 值6.8 磷酸盐缓冲液1 000 mL 为溶出介质,转速为50 r·min-1,依法操作,经30 min 时,取溶液适量,滤过,滤液于室温条件下放置,于0、1、2、4、6、10 和12 h精密量取滤液适量,用溶出介质稀释制成每1 mL 含16 μg 的溶液后取样测定。照紫外-可见分光光度法,在250 nm 处测定吸光度。
结果供试溶液室温放置的吸光度的RSD 值为0.22%,不大于2.0%。说明此溶液在室温条件下12 h 内稳定,结果见表5。
2.2.6 重复性试验
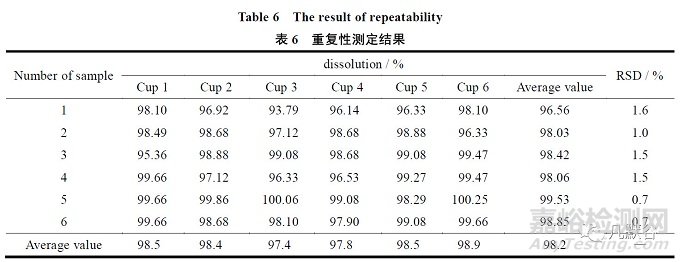
取样品6 片,按照“2.1”条中的溶出度方法测定,每杯样品分别取样6 次,分别过滤测定,各片样品溶出度6 次测定结果的相对标准偏差均不大于2.0%,说明方法重复性良好,结果见表6。
2.2.7 中间精密度试验
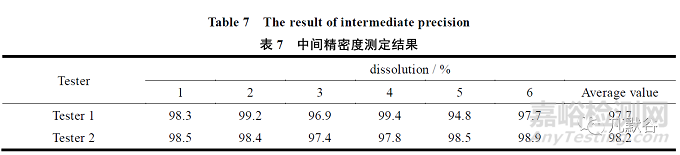
由不同分析人员,不同时间使用不同的仪器对同一批样品进行测试,样品溶出度平均结果的偏差不大于5.0%,说明方法中间精密度良好,结果见表7。
2.2.8 耐用性试验
2.2.8.1 溶出条件的耐受性试验
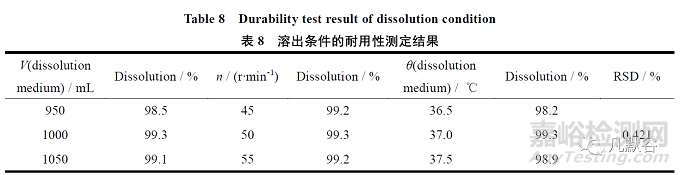
考察溶出介质体积的变化约±5%,溶出温度变化±0.5 ℃、转速相对值变化±5 r·min-1,进行测定时溶出度的变化情况。
耐用性各条件项下的溶出数据的RSD 值为0.42%,小于2.0%,耐用性良好,结果见表8。
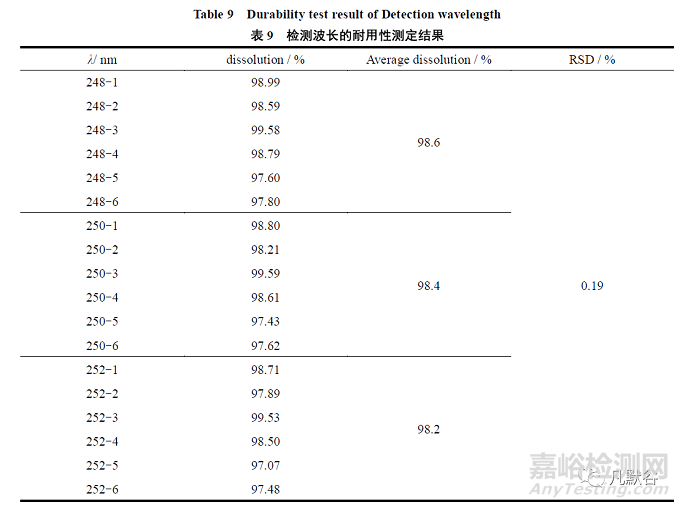
2.2.8.2 检测波长的耐用性试验
改变本品的检测波长(250±2)nm,照紫外-可见分光光度法进行测定,耐用性各条件项下的溶出数据的RSD 值为0.185%,小于2.0%,耐用性良好,结果见表9。
2.2.9 溶出均一性试验
取自制样品(批号XS1405001)6 片,根据“2.1”条中的溶出度方法,分别在5、10、15、20、30 和45 min 取样,测定各样品的溶出曲线,确定其溶出均一性。样品在各个时间点的溶出RSD 分别为1.8%、1.1%、1.0%、0.94%、0.93%和0.81%,测定结果见表10。
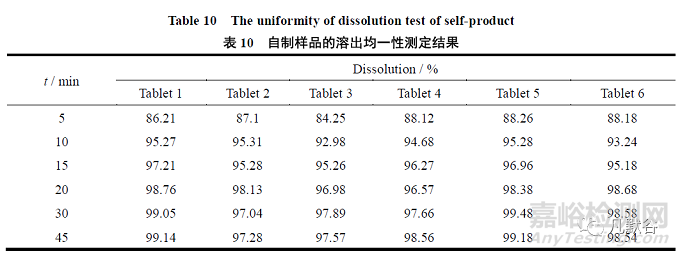
结果表明,在pH值6.8 介质中的本品溶出批内均一性良好。
2.2.10 溶出重现性试验
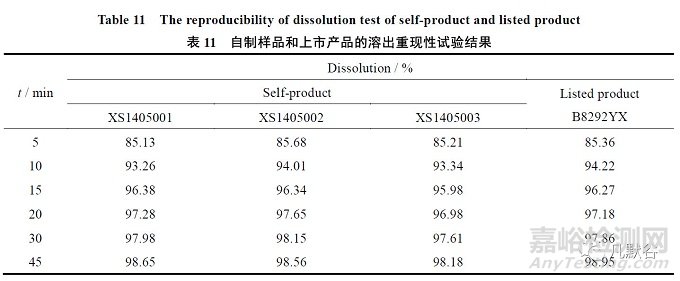
取中试样品XS1405001、ZS1405002、ZS1405003 三批次供试品及上市品B8292YX,每批取6 片,于5、10、15、20、30 和45 min 时吸取溶出液适量,测定溶出量,结果表明产品溶出重现性良好,与上市品相似。
3 结论
在《中华人民共和国药典》2015 年版二部及《美国药典》USP39 中,缬沙坦片均采用紫外可见分光光度法测定溶出度。
作者根据两药典规定的溶出条件,采用紫外分光光度法建立了缬沙坦片溶出度的体外分析方法,并系统的进行了方法学研究,验证结果表明,该方法专属性、线性、重复性、准确度、耐用性均符合要求,为体外溶出度的检测提供科学合理的试验方法。
参考文献
详见 中国药剂学杂志 2019 年9 月第17 卷 第5 期

来源:药物分析之家


