您当前的位置:检测资讯 > 行业研究
嘉峪检测网 2023-02-13 05:52
摘 要 Abstract
2017 年年初至2022 年6 月底,按照原料药、剂型和规格统计,国家药品监管部门共批准31个用于治疗儿童神经系统疾病的新化学药品上市,不断满足儿科神经系统疾病临床用药需求。本文根据国家药品监管部门批准的药品说明书以及相关文献,简要介绍近年来获批的神经系统儿童用新化学药品的概况、适应症、作用机制、剂型与规格、品种特点等相关情况。
From 2017 to 2022.June, national drug regulatory authority has approved 31 chemical small molecule pediatric medications for the treatment of neurological diseases, including new molecular entities, new dosage forms and new strength of chemical drugs. According to the prescription information for professionals and the related literature, this review describes the descriptions, indications, mechanism of action, dosage forms, strength and characteristics of these medicines for children.
关键词 Key words
儿童用药;神经系统疾病;化学药品;优先审评;适应症
pediatric medication; nervous system diseases; chemical drugs; priority review; indications
神经系统疾病是儿童常见疾病,病种繁多、发病机制和病情复杂,而且发病率不断上升,同时由于儿童神经系统尚处于发育阶段且具有神经功能变化较大等生理特征,其疾病谱、治疗和预后均与成人有显著差别[1]。儿童用神经系统药物品种少、适宜剂型和规格缺乏、不规范处方行为和不合理用药等问题突出[2-3]。
为解决儿童用药难题,2016年以来,我国发布了3 批《鼓励研发申报儿童药品清单》(以下简称《鼓励研发清单》),总计106个品种,其中神经系统药物约占22%[4-6]。国家药品监督管理局(National Medical Products Administration,NMPA) 多措并举创新和优化儿童用药审评审批机制,持续释放鼓励儿童用药创新研发的政策红利,促使儿童用药研发和审评审批保持高速增长势头。2021 年,NMPA 批准47 个儿童用药上市,其中14 个通过优先审评审批程序获批,创历史新高[7-11]。2017 年年初至2022 年6 月底,国家药品监管部门共批准用于治疗儿童神经系统疾病的新化学药品31 个,按批准文号计,共85 件,不断满足儿科神经系统疾病临床用药需求。
本文汇总了2017 年年初至2022 年6 月底按照化学药品注册分类批准上市的治疗儿童神经系统疾病的新化学药品,根据药品说明书以及相关文献,简要介绍这些儿童用新化学药品的概况、适应症、作用机制、剂型与规格、品种特点等相关情况。
1 批准上市的神经系统儿童用新化学药品基本概况
本文根据“国家药品监管数据共享平台”数据库检索结果,结合年度药品审评报告、加快审评程序公开信息和相关文献,按照原料药、剂型和规格统计,2017 年年初至2022 年6 月底,国家药品监管部门共批准31 个用于治疗儿童神经系统疾病的新化学药品。按照适应症统计,包括抗癫痫药16 个、局部麻醉药1 个、抗精神分裂药1 个、镇静催眠药9 个、注意缺陷多动症治疗药1个和肌无力治疗药3 个。按化学药品注册分类统计,包括13 个5.1类新药、2 个2.2 类改良型新药、16 个5.2 类和3 类儿童适宜剂型规格仿制药;按剂型统计,包括9 个口服溶液剂、8 个注射剂、11 个口服固体制剂、2 个糖浆剂和1 个灌肠剂(表1);按批准文号统计,共有85 件,其中国产批准文号60 件、进口批准文号25 件。
在31 个批准上市药品中,有9 个品种已列入《鼓励研发清单》,约占批准品种总数的29.0% ;有17 个品种已列入国家医保目录,约占批准品种总数的54.8% ;有18 个品种按照儿童用药纳入优先审评审批程序,约占批准品种总数的58.1%。儿童用罕见病药物有3 个,分别为诺西那生钠注射液、利司扑兰口服溶液用散和盐酸芬戈莫德胶囊。
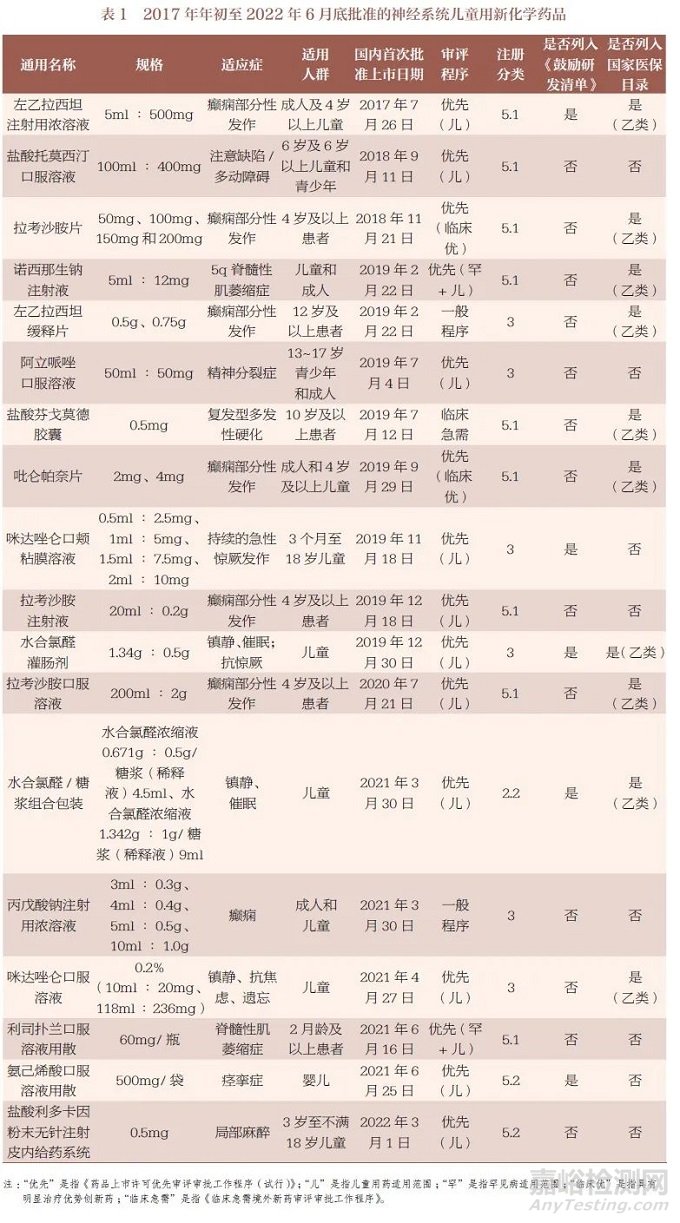
2 神经系统儿童用新化学药品简介
2.1 抗癫痫药
癫痫是神经系统常见疾病,大致可分为全面性发作、局灶性发作和未知起始发作[12]。目前,服用抗癫痫药物(antiepileptic drugs,AEDs)是治疗癫痫的主要方法[13-15]。我国癫痫患者已超过1000 万人,儿童发病率较高[16]。同时由于儿童特殊生理特点和癫痫疾病临床表现的多样性和复杂性,癫痫治疗领域儿童用药物一直存在巨大的临床需求。近5 年国家药品监管部门批准了适宜儿童的抗癫痫新药共计16 个品种,68 件批准文号。
2.1.1 丙戊酸钠注射用浓溶液
概况:丙戊酸钠注射用浓溶液于1996 年在德国上市。NMPA 于2021 年批准首个丙戊酸钠注射用浓溶液仿制药上市。
适应症:用于治疗癫痫,在成人和儿童中。
作用机制:主要作用于中枢神经系统,其作用机制可能与增加γ- 氨基丁酸的浓度有关。
剂型与规格:注射剂,3 m l ∶ 0 . 3 g 、4 m l ∶ 0 . 4 g 、5ml∶0.5g 和10ml∶1.0g。
品种特点:丙戊酸钠为第一代AEDs,为癫痫诊疗指南一线用药[13]。国内已上市丙戊酸钠制剂包括普通片剂、缓释片、口服溶液剂和冻干粉针剂。当癫痫患者不能服用口服制剂时,注射剂可用于替代口服剂型。与已上市的注射用丙戊酸钠相比,本品为溶液型注射液,采用终端灭菌工艺,提高了制剂无菌保证水平;另外本品临床使用中无需复溶,可直接稀释使用, 降低了使用过程中的风险, 且增加了使用便捷性[17]。
2.1.2 左乙拉西坦注射用浓溶液和缓释片
概况:左乙拉西坦注射液和缓释片分别于2006 年和2008年在美国首次批准上市。国家药品监管部门于2017 年批准原研药左乙拉西坦注射用浓溶液在国内上市,后于2019 年批准左乙拉西坦缓释片仿制药上市[18]。
适应症:①左乙拉西坦注射用浓溶液:用于成人及4 岁以上儿童癫痫患者部分性发作(伴或不伴继发性全面性发作)的加用治疗。②左乙拉西坦缓释片:用于12 岁及以上的癫痫患者部分性发作的加用治疗。
作用机制:左乙拉西坦抗癫痫作用的确切机制尚不清楚。有研究显示,左乙拉西坦可能通过影响神经元内钙离子浓度而产生抗癫痫作用[14]。
剂型与规格:① 注射剂:5ml∶500mg。②缓释片:0.5g、0.75g。
品种特点:左乙拉西坦为第二代AEDs,是中国抗癫痫协会《临床诊疗指南·癫痫病分册》推荐的一线用药[14]。左乙拉西坦片和口服溶液于2012 年前已批准进口我国,用于儿童和成人的癫痫治疗。左乙拉西坦注射用浓溶液于2016 年5 月被列入首批《鼓励研发清单》。在鼓励政策下,原研制剂于2017 年按照儿童用药优先审评审批程序在国内批准上市。在临床治疗癫痫的过程中,口服药物会经常出现不适用的情形,如呕吐、腹泻、吸收障碍等,急需采用注射液作为短期替代剂型延续原有治疗。该注射剂为国内左乙拉西坦口服制剂的替代选择,在患者无法应用口服制剂时可将该浓溶液与0.9% 氯化钠注射液、乳酸钠林格注射液或5%葡萄糖注射液稀释后静脉给药。口服和静脉给药可以直接转换,无需逐步增加或减少药物剂量。与普通口服制剂相比,左乙拉西坦缓释片采用骨架型缓慢释放机制,将服药次数由2 次/ 日降低至1 次/ 日,提高了用药依从性。
2.1.3 拉考沙胺片、注射液和口服溶液
概况:拉考沙胺的片剂、注射剂和糖浆剂最早于2008 年在欧盟获准上市,现已在全球超过70 个国家上市销售。原研药拉考沙胺片、注射液和口服溶液先后于2018 年、2019 年和2020 年获准在国内上市[19-21]。
适应症:拉考沙胺片、注射液和口服溶液均用于4 岁及以上癫痫患者部分性发作的联合治疗。
作用机制:拉考沙胺体内抗癫痫作用的确切机制尚未充分阐明。体外电生理研究显示,拉考沙胺可选择性作用于慢失活钠通道,减少钠离子内流,降低神经元兴奋[15]。
剂型与规格:①片剂:50mg、100mg、150mg 和200mg。②注射剂:20ml∶0.2g。③口服溶液剂:200ml∶2g。
品种特点:拉考沙胺为第三代新型的AEDs。与传统的钠离子通道阻滞剂机制不同,本品通过选择性作用于钠通道的慢失活来稳定神经元细胞膜,降低神经元持续兴奋, 且不影响钠通道的快失活, 在有效控制癫痫发作的同时不影响正常生理功能。另外,拉考沙胺不经肝脏代谢,因此其不良反应更少、药物耐受性更佳[14-15]。拉考沙胺片率先在国内上市,填补国内市场空白;当患者无法口服给药时,拉考沙胺注射液作为口服制剂的一种替代给药选择;而拉考沙胺口服溶液可满足低龄患者或有吞咽障碍受试者的治疗需求。
2.1.4 吡仑帕奈片
概况:吡仑帕奈片于2012年在欧盟获准上市,现已在美国、日本和加拿大等50 多个国家和地区上市销售。2019 年原研药吡仑帕奈片首次在国内上市[22]。
适应症:用于成人和4 岁及以上儿童癫痫部分性发作患者(伴有或不伴有继发全面性发作)的治疗。
作用机制:吡仑帕奈体内抗癫痫作用的确切机制尚不清楚。它是一种具有口服活性、非竞争性和高选择性的α- 氨基-3-羟基-5- 甲基-4- 异唑丙酸(AMPA) 受体拮抗剂。AMPA受体在调节皮质谷氨酸能神经传递中起关键作用[14]。
剂型与规格:片剂,2mg、4mg。
品种特点:吡仑帕奈是目前唯一一个作用于AMPA 受体的第三代新型AEDs,其特殊的作用机制为抗癫痫药物的联合使用提供了更多的选择[14]。有文献报道,吡仑帕奈可用于儿童多种病因、多种发作类型的癫痫,也可用于婴儿严重肌阵挛癫痫(Dravet 综合征)和伦诺克斯- 加斯托综合征(Lennox-Gastaut 综合征)等难治性癫痫综合征[23]。吡仑帕奈符合一级药代动力学特征,有研究显示,2~12 岁儿童的吡仑帕奈药代动力学特征与青少年和成人相似,吡仑帕奈的清除率与年龄体重等因素无关。而联用酶诱导抗癫痫药物(EIAEDs)会增加吡仑帕奈的清除率[23]。基于此,本品的初始剂量不需要根据体重调整剂量,但可以根据体重范围进行分层。此外,本品在联用卡马西平、奥卡西平、托吡酯等EIAEDs 时,无需改变起始剂量,可以考虑加快加量速度[23]。
2.1.5 氨己烯酸口服溶液用散
概况:氨己烯酸于1989 年已经在英国批准用于儿童和成人的癫痫难治性部分性发作的辅助治疗,1996 年被批准用于婴儿痉挛症的治疗。2009 年美国食品药品监督管理局(FDA) 批准氨己烯酸散剂和片剂在美国上市。NMPA 于2021 年批准首个氨己烯酸口服溶液用散仿制药进口上市。
适应症:用于婴儿痉挛症;当潜在获益大于潜在视力损伤风险时,可用于1 个月到2 岁婴儿痉挛症患儿的单药治疗。
作用机制:氨己烯酸是γ-氨基丁酸(GABA)类似物,通过不可逆地与γ- 氨基丁酸转氨酶结合抑制γ- 氨基丁酸的分解,导致脑内γ- 氨基丁酸浓度增加而产生抗癫痫作用。
剂型与规格:散剂,500mg/袋。
品种特点:婴儿痉挛症又称West 综合征,是婴儿时期特有的癫痫综合征。婴儿痉挛症目前治疗困难,一旦发作病情难以控制,70%~90% 伴有严重的认知功能障碍,预后不良。氨己烯酸列为婴儿痉挛症的一线用药[24]。氨己烯酸散剂于2017 年被列入我国第二批《鼓励研发清单》,2019年纳入第二批临床急需境外新药名单。2021 年首个氨己烯酸制剂在国内批准上市,剂型为散剂。临床上本品用水配成50mg/ml 的溶液,用定量取药器根据婴儿体重准确量取剂量服用。氨己烯酸口服溶液用散批准上市为国内临床应用提供了可获得的治疗选择。
2.2 局部麻醉药——盐酸利多卡因粉末无针注射皮内给药系统
概况:盐酸利多卡因粉末无针注射皮内给药系统于2007 年通过505(b)(2) 路径( 新剂型)获准在美国上市,商品名为Zingo®,2022 年获准进口国内。
适应症:用于3 岁至不满18岁儿童的静脉穿刺或外周静脉插管前皮肤局部麻醉。
作用机制:利多卡因是一种酰胺类局部麻醉药,通过阻断神经冲动的产生和传导所需的钠离子通道,产生局部麻醉作用。
剂型与规格:注射剂,0.5mg。
品种特点:国内已有盐酸利多卡因注射液、胶浆、凝胶、气雾剂、乳膏等剂型上市。本品为国内首个盐酸利多卡因皮内给药系统,由三部分组成,一个装有0.5mg 粒径约40μm 盐酸利多卡因粉末的药盒,一个高压氦气瓶和一个安全锁组成的给药装置。采用氦气高压喷射原理,通过给药装置内的加压氦气加速作用使盐酸利多卡因细粉穿透表皮到达作用部位而快速产生局部麻醉作用,以减轻或消除静脉穿刺和插管操作引起的疼痛。可直接在手背或前臂给药,给药后1~3 分钟,皮肤局部麻醉作用即起效,麻醉作用在给药后10 分钟内减弱。本品通过透皮给药,无明显痛感,起效快,为我国儿童特别是低龄儿童静脉穿刺或外周静脉插管前皮肤局部麻醉提供新的用药选择[25-26]。
2.3 抗精神分裂药——阿立哌唑口服溶液
概况:阿立哌唑口服溶液最早于2004 年在美国批准上市。2019 年国内批准首个阿立哌唑口服溶液仿制药上市。
适应症:用于13~17 岁青少年和成人的精神分裂症。
作用机制:阿立哌唑具有突触前多巴胺激动和突触后多巴胺D2 拮抗作用,伴有5- 羟色胺1A受体(5-HT1A) 部分激动作用和5- 羟色胺2A 受体(5-HT2A)拮抗作用。
剂型与规格:口服溶液剂,50ml∶50mg。
品种特点:阿立哌唑为非典型抗精神病药物,国内已上市片剂、口崩片和胶囊剂。与上市的口服固体制剂相比,阿立哌唑口服溶液易于吞咽,能够根据患者体重灵活调节剂量并确保给药准确度,有利于提高患者用药依从性,确保用药安全及有效。
2.4 镇静催眠药
水合氯醛和咪达唑仑均已列入英国《NICE 指南:儿童及青少年诊疗操作中的镇静》[27] 和国内《热性惊厥诊断治疗与管理专家共识(2017 实用版)》[28]。2016 年,水合氯醛口服溶液、口服混悬液、灌肠液和咪达唑仑口腔黏膜溶液均被列入首批《鼓励研发清单》。
2.4.1 水合氯醛灌肠剂、水合氯醛/ 糖浆组合包装
概况:水合氯醛已有超过120 年的临床应用历史,国外上市剂型包括口服溶液剂、糖浆剂、栓剂、灌肠剂等。国内水合氯醛口服溶液、灌肠剂主要作为医院制剂使用,广泛用于儿科检查的镇静催眠。NMPA 先后于2019年和2021 年批准国内首个水合氯醛灌肠剂和水合氯醛/ 糖浆组合包装制剂上市[9,11]。
适应症:①水合氯醛灌肠剂:用于儿童检查、操作前的镇静、催眠,以及监护条件下抗惊厥。②水合氯醛/ 糖浆组合包装:用于儿童检查、操作前的镇静、催眠。水合氯醛灌肠剂和糖浆剂均被批准用于小于1 个月的早产儿、新生儿。
作用机制:水合氯醛为类似于巴比妥类的中枢神经抑制作用的镇静催眠药。作用机制尚不完全清楚,目前认为主要是由其活性代谢产物三氯乙醇产生中枢神经抑制作用。
剂型与规格:① 灌肠剂:1.34g∶0.5g。② 糖浆剂:水合氯醛浓缩液0.671g∶0.5g,糖浆(稀释液)4.5ml ;水合氯醛浓缩液1.342g∶1g,糖浆(稀释液)9ml。
品种特点:水合氯醛是我国临床儿科检查镇静首选药物。水合氯醛/ 糖浆组合包装采用新的处方工艺按照改良型新药批准上市。改良制剂将活性成分与稀释液分开包装,可以有效提升产品质量稳定性;使用时采用精密注射器量取临床用量,以实现精确分剂量;处方中添加适宜矫味剂以矫正不良气味,从而提高儿童用药依从性。水合氯醛灌肠剂按照仿制药在国内批准上市,制剂采用预灌封包装,通过直肠给药。水合氯醛灌肠剂可在患儿不能配合口服的情况下使用。临床给药方便,给药剂量准确[29-30]。
2.4.2 咪达唑仑口服溶液
概况:咪达唑仑口服溶液于1998 年在美国批准上市。2021年国内首个咪达唑仑口服溶液仿制药获批上市。
适应症:用于儿童诊断或治疗性操作前以及操作过程中的镇静/ 抗焦虑/ 遗忘;也可用于儿童术前镇静/ 抗焦虑/ 遗忘。
作用机制:咪达唑仑是一种短效的苯二氮.类中枢神经系统抑制剂,其中枢抑制作用是通过增强抑制性突触的γ- 氨基丁酸能神经传递而介导的。当存在苯二氮.类药物时,通过正向变构调节增强γ- 氨基丁酸受体对神经递质的亲和力,从而增强γ-氨基丁酸受体对突触后跨膜氯离子通量的作用。
剂型与规格:口服溶液剂,10ml∶20mg、118ml∶236mg。
品种特点:咪达唑仑属于第二类精神药品。国内已有马来酸咪达唑仑片和咪达唑仑注射液上市,其中片剂仅适用于成人用药。在国内批准口服溶液剂前,临床中常使用注射液混合果酱果汁口服给药,来达到镇静、抗焦虑作用。咪达唑仑口服溶液是专门针对儿科人群开发的新剂型,其通过在处方中增加矫味剂来掩盖咪达唑仑的苦味,进而提高用药依从性。
2.4.3 抗惊厥药——咪达唑仑口颊粘膜溶液
概况:咪达唑仑口颊粘膜溶液于2010 年在欧盟批准用于婴幼儿惊厥发作。我国于2019 年批准首个咪达唑仑口颊粘膜溶液仿制药上市[9]。
适应症:用于治疗3 个月至18 岁儿童持续的急性惊厥发作。
作用机制:同咪达唑仑口服溶液。
剂型与规格:口服溶液剂,0.5ml ∶ 2.5mg、1ml ∶ 5mg、1.5ml∶7.5mg、2ml∶10mg。
品种特点:小儿惊厥常为突然发作,发作时通过静脉注射、肌内注射、直肠灌注等方式给药较为困难。咪达唑仑口颊粘膜溶液通过黏膜途径给药。本品采用无针预灌封包装,通过将注射器的顶部伸入到患儿面颊内侧和下部牙龈之间推入药液。本品可在紧急并未建立静脉通道情况下通过口腔黏膜给药,临床使用方便,生物利用度高,且吸收迅速,起效快。口颊黏膜给药方式可弥补静脉注射、肌内注射等给药途径的不足,为儿童急性惊厥发作的治疗提供一项新的、更为便捷的给药方式[9]。
2.5 注意缺陷多动症治疗药——盐酸托莫西汀口服溶液
概况:盐酸托莫西汀口服溶液于2013 年在日本上市,2018年首次批准进口国内。
适应症:用于治疗6 岁及6岁以上儿童和青少年的注意缺陷/多动障碍(ADHD)。
作用机制:托莫西汀是一种具有高度选择性的强效突触前去甲肾上腺素转运体抑制剂,其对5- 羟色胺或多巴胺转运体无直接影响,对其他去甲肾上腺素能受体或对其他神经递质转运体或受体的亲和力极小。
剂型与规格:口服溶液剂,100ml∶400mg。
品种特点:注意缺陷多动症主要表现为难以集中注意力、活动过度及冲动。临床常用中枢神经系统兴奋剂哌甲酯作为治疗药物。文献显示,哌甲酯和盐酸托莫西汀口服溶液均能持续改善注意缺陷多动症的症状,提高患者执行功能表现[31]。盐酸托莫西汀胶囊为首个非兴奋剂类注意缺陷多动症治疗药物,原研胶囊剂于2006 年已批准进口我国。与已上市的胶囊剂相比,盐酸托莫西汀口服溶液具有可依据患者体重准确调整剂量及服用方便的特点,为吞咽困难或低龄儿童提供了新的治疗选择[32]。
2.6 罕见病药物和临床急需药物
2018 年5 月我国发布《第一批罕见病目录》,其中就包含脊髓性肌萎缩症和多发性硬化。
2.6.1 诺西那生钠注射液
概况:诺西那生钠注射液于2016 年在美国批准上市,2018年纳入我国第一批临床急需境外新药名单,2019 年首次批准进口我国[9, 33]。
适应症:用于治疗5q 脊髓性肌萎缩症,也可用于脊髓性肌萎缩症儿科患者的治疗。
作用机制:体外试验和脊髓性肌萎缩症转基因动物模型试验显示,诺西那生钠是一种反义寡核苷酸, 可调节运动神经元存活基因2(SMN2) 信使RNA(mRNA) 剪接, 促使7 号外显子编入mRNA 中,从而增加SMN2基因产生全长蛋白的数量,达到治疗脊髓性肌萎缩症的目的。
剂型与规格:注射剂,5ml∶12mg。
品种特点:脊髓性肌萎缩症是由于运动神经元存活基因(SMN)突变导致SMN 蛋白功能缺陷引起的遗传性神经肌肉病,主要临床特征是肌无力和肌萎缩。脊髓性肌萎缩症发病率为1/10000~1/6000, 是造成婴幼儿死亡最常见的常染色体隐性遗传疾病之一。诺西那生钠为18 个修饰的寡核苷酸组成的RNA,属反义寡核苷酸药物。本品通过鞘内注射给药,为国内第一个脊髓性肌萎缩症治疗药物,缓解国内无药可用的临床现状。
2.6.2 利司扑兰口服溶液用散
概况:利司扑兰口服溶液用散于2020 年8 月率先在美国批准上市,2021 年6 月基于国际多中心临床试验结果并通过优先审评审批程序在国内批准上市[11]。
适应症:用于2 月龄及以上患者的脊髓性肌萎缩症(SMA)。
作用机制:利司扑兰是SMN2 的剪接修饰剂,直接靶向疾病的潜在分子缺陷,增加中枢组织和外周组织的功能性SMN蛋白的产生[34]。
剂型与规格:散剂,60mg/瓶。
品种特点:与鞘内给药的诺西那生钠注射液相比,利司扑兰是一种口服生物利用度高的小分子化合物。临床上将利司扑兰口服溶液用散配制成0.75mg/ml 浓度的口服溶液,然后通过口服或者鼻胃管给药。本品能为无法接受重复鞘内注射的患者提供获益,也适合脊髓性肌萎缩症所有年龄组经皮胃造瘘插管或经鼻胃管喂养的患者。除预期的影响中枢神经系统外, 本品通过口服给药产生全身暴露, 还会影响外周肌肉和组织, 获得更大的临床获益。
2.6.3 盐酸芬戈莫德胶囊
概况:盐酸芬戈莫德胶囊于2010 年在俄罗斯获准上市,目前已在80 多个国家获得上市许可。盐酸芬戈莫德胶囊于2018 年列入我国第一批临床急需境外新药名单,2019 年首次进口我国。
适应症:用于10 岁及以上患者复发型多发性硬化(RMS)的治疗。
作用机制:在体内芬戈莫德被鞘氨醇激酶代谢为活性代谢物芬戈莫德- 磷酸酯。芬戈莫德-磷酸酯是鞘氨醇-1- 磷酸受体调节剂,并且与鞘氨醇-1- 磷酸受体1、3、4、5 高亲和力结合[35]。
剂型与规格:胶囊剂,0.5mg。
品种特点:多发性硬化是一种免疫介导的中枢神经系统慢性炎性脱髓鞘性疾病,病因不明。病变具有空间多发和时间多发特点。病理表现为中枢神经系统多发髓鞘脱失,可伴有轴突及神经细胞受损。《罕见病诊疗指南》中推荐用于多发性硬化修正治疗的口服化学药物中,芬戈莫德是唯一一个批准用于儿童的多发性硬化治疗化学药物[36]。
3 总 结
2017 年年初至2022 年6月底,国家药品监管部门批准治疗儿童神经系统疾病的新化学药品共计31 个品种、85 件批准文号。按照适应症统计,其中抗癫痫药约占51.6%、镇静催眠药约占29.0%。按照制剂类型统计,液体制剂占比达到64.5%, 包括口服溶液剂、注射剂、糖浆剂和灌肠剂。此外,还有2 个口服溶液用散在使用时配制成溶液服用。这主要是由于液体制剂具有可根据儿童体重准确调整剂量的优点,而成为儿童用药开发的热点方向。另外,还批准上市了2种针对儿童生理特征和神经系统疾病特点专门设计的新型递药系统:口颊粘膜溶液和无针注射皮内给药系统。
这31 个儿童用新化学药品,填补了国内神经系统疾病某些治疗领域和儿童适宜剂型规格的空白,一定程度上缓解了儿童用药短缺问题。在已批准上市的品种中,按照临床优势改良型新药或者质量和疗效与参比制剂一致的仿制药批准上市的约占70.6%(按批准文号计),且目前已有17 个品种纳入国家医保目录,其中包括罕见病药物诺西那生钠注射液和临床急需药物盐酸芬戈莫德胶囊,不仅提升了用药可及性还极大地减轻了患儿家庭的经济负担。

来源:中国食品药品监管杂志


