[摘要] 参比制剂是仿制药研发的标杆和基础。本文介绍了我国化学仿制药参比制剂的遴选工作背景、遴选原则和路径,美国参比制剂的确定及管理模式,通过分析中美两国参比制剂选择管理的异同,为进一步完善我国参比制剂遴选及管理工作提供参考。
近年来,为提高仿制药质量和药品审批标准,我国开展了仿制药质量和疗效一致性评价工作,并进行了化学药品注册分类改革。参比制剂的遴选工作起源于仿制药质量和疗效一致性评价,服务于新注册分类仿制药的研发申报、审评审批。
2022年,国家药品监督管理局公布了《中华人民共和国药品管理法实施条例( 修订草案征求意见稿) 》[1],其中第二十一条化学仿制药研发指出: 国务院药品监督管理部门遴选发布仿制药参比制剂目录,化学仿制药研发应当参照相关技术指导原则选择参比制剂或者对照药物。因此对于化学仿制药的研发,参比制剂的选择至关重要。我国化学仿制药参比制剂的遴选与确定从无到有,正处在不断完善的发展阶段,而美国化学仿制药参比制剂的管理相对成熟。本文通过介绍我国参比制剂遴选工作情况和美国化学仿制药参比制剂的管理模式,对比分析中美两国参比制剂管理模式的异同,为完善我国参比制剂管理模式提供参考。
一、我国参比制剂遴选工作的简介
1.1 参比制剂遴选背景
为鼓励研究和创制新药、提高审评审批质量和透明度、提高仿制药质量,2015年8月18日,国务院发布了《关于改革药品医疗器械审评审批制度的意见》( 国发〔2015〕44 号) [2],指出我国已经批准上市的仿制药,需按与原研药品质量和疗效一致的原则,分期分批进行质量一致性评价,药品生产企业应将其产品与参比制剂进行质量一致性评价; 同时指出要调整药品的注册分类,明确仿制药审评审批要以原研药品作为参比制剂,确保新批准的仿制药质量和疗效与原研药品一致。
2016年3月5日,国务院办公厅发布了《关于开展仿制药质量和疗效一致性评价的意见》( 国办发〔2016〕8 号) ( 以下简称8号文) [3],进一步明确了一致性评价的对象,即化学药品新注册分类实施前未按照与原研药品质量和疗效一致原则审批批准上市的仿制药; 同时也进一步明确了参比制剂的遴选原则,即参比制剂原则上首选原研药品,也可以选用国际公认的同种药品。2016 年 3 月 9 日,原国家食品药品监督管理总局发布了《关于发布化学药品注册分类改革工作方案的公告》( 2016 年第 51 号)[4],对化学药品注册分类进行调整,明确化学药品新注册分类 3 类和 4 类仿制药应与原研药品的质量和疗效一致。随着注册分类改革推进,新修订《药品注册管理法》( 2020) 、《化学药品注册分类及申报资料要求》( 2020) 等法规文件中规定: 仿制药应当与参比制剂质量和疗效一致,申请人应当参照相关技术指导原则选择合理的参比制剂。
1.2 参比制剂遴选工作依据
为贯彻落实 8 号文精神要求,进一步对参比制剂的遴选原则、路径、确定程序和资料要求予以明确,2016 年 3 月和 5 月原国家食品药品监督管理总局分别发布了《关于发布普通口服固体制剂参比制剂选择和确定等 3 个技术指导原则的通告》( 2016年第 61 号) [5]和《关于发布仿制药质量和疗效一致性评价参比制剂备案与推荐程序的公告》( 2016 年第 99 号) ( 以下简称 99 号文) [6],标志着参比制剂申请及遴选工作正式启动。
2019 年 3 月,国家药品监督管理局发布了《关于发布化学仿制药参比制剂遴选与确定程序的公告》( 2019 年第 25 号) ( 以下简称 25 号公告) [7],对参比制剂遴选原则、路径、时限、确定程序等关键环节进一步予以规范,25 号公告的发布明确废止了 99号文; 公告同时指出原发布的参比制剂相关文件与25 号公告不一致的,以 25 号公告为准,因此目前我国参比制剂的遴选工作以 25 号公告的程序作为依据。
为进一步提高参比制剂遴选效率,2020 年 10月,国家药品监督管理局药品审评中心( 以下简称药审中心) 发布了《关于化学仿制药参比制剂遴选申请资料的通告》( 2020 年第 32 号) [8],细化了企业参比制剂申请资料的要求,包括申请综述、调研信息、调研信息网址链接、附件及填写说明。
1.3 参比制剂公示/发布总体情况
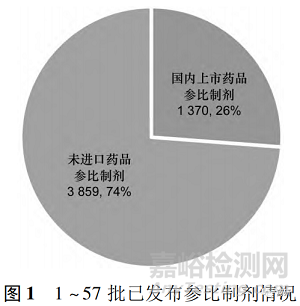
参比制剂是仿制药研发的对照药物,只有国家药品监督管理局官网正式发布的才是被认可的参比制剂。一个被认可的参比制剂包括 5 个基本要素,即中英文通用名、商品名、规格、持证商和来源地,如缬沙坦胶囊( valsartan capsules) ,商品名为 Diovan,规格为 40 mg,持证商为 Novartis,来源为美国橙皮书。截至 2022 年 9 月,药审中心已公示《化学仿制药参比制剂目录( 第六十二批) 》,国家药品监督管理局已累计发布《化学仿制药参比制剂目录( 第五十七批) 》。对 1 ~ 57 批已发参比制剂进行统计,目录共收载 5 229 个参比制剂( 计 1988 个品种) ,原研药品参比制剂总计 4995 个,占比约 96% ,国际公认的同种药品参比制剂总计 223 个,占比约 4% ; 国内上市药品参比制剂总计 1370,占比 26% ,未进口药品参比制剂总计 3859,占比约 74% ( 见图 1) 。
二、我国参比制剂遴选原则及路径介绍
2.1 我国参比制剂选择的原则
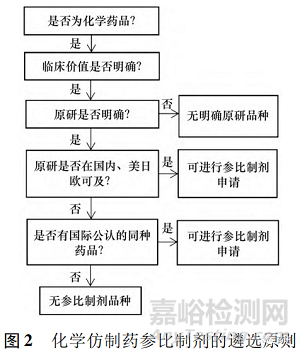
25 号公告明确了现行化学仿制药参比制剂选择的顺序,具体依次为: ① 选择原研药品作为参比制剂,包括国内上市的原研药品、经审核确定的国外原研企业在中国境内生产或经技术转移生产的药品、未进口原研药品。② 若原研药品不可及或因质量原因不适合作为参比制剂,可选择国际公认的同种药品( 即在美国、日本或欧盟等获准上市并获得参比制剂地位的仿制药) 作为参比制剂。③ 可选择经国家药品监督管理局评估确定具有安全性、有效性和质量可控性的药品作为参比制剂。见图 2。
2.2 参比制剂选择的路径介绍
2.2.1 参比制剂申请路径
25 号公告确定了 2 条参比制剂的遴选路径: ① 基于企业主动提出申请/推荐路径。② 基于药审中心主动推荐路径。2 条路径的参比制剂遴选确定都需要经专家委员会审议,药审中心公示,国家局发布。其中,企业主动提出申请路径包括 2 种具体情形: ①企业推荐非本企业的药品及企业申请本企业原研进口的药品作为参比制剂,需要在药审中心参比制剂遴选申请平台的“申请/推荐其他药品作为参比制剂”模块提出申请。②原研企业申请本企业的药品作为参比制剂,需要在参比制剂遴选申请平台的“申请自证作为参比制剂”模块提出申请。
企业通过参比制剂遴选申请平台向药审中心提出申请,药审中心在 60 个工作日内予以公示。平台入口在药审中心仿制药一致性评价专栏中的参比制剂遴选申请平台( 网站: https: / /www.cde.org.cn /yzxpj /listpage /2eabd605a7e7ab135518fdf4d04fc51e) ,登录申请人之窗后进行填报。药审中心对业界提交的申请资料进行审核并形成初步审核意见,提交专家委员会审议。审议后,药审中心将对外公示审议结果,结果分为通过、未通过,公示期为 10 个工作日,如有异议,企业需要在“申请参比制剂存疑品种”模块提出申请。公示结束后,对无异议的品种报国家药品监督管理局,对有异议品种按照参比制剂存疑处理方式处理。
2.2.2已发布参比制剂调整路径
随着制药技术的发展、药品监管体系的完善,在药品审评过程中发现已发布参比制剂无法符合现行《中华人民共和国药典》或现行审评技术要求,此类药品不鼓励仿制,部分药品因安全或有效性原因撤市,为确保仿制药安全有效性,此类药品经评估风险大于获益的亟需调出参比制剂目录。为进一步实现参比制剂的动态管理,促进仿制药高质量发展,2022 年 3 月药审中心对外征求《已发布化学仿制药参比制剂调整程序》的意见,征求意见稿中明确了参比制剂的调整情形和提出路径,设置了公示及异议处理流程。
三、美国参比制剂管理模式
美国的新药申请一般分为 3 大类型,即创新药物及其制剂的申请( 新药申请,new drug application,NDA) 、仿 制 药 的 申 请( 简 略 申 请,abbreviated newdrug application,ANDA) 和非处方药( over the counterdrugs,OTC) 的申请。其中,通过 ANDA 上市的药品需要与参比制剂进行对比,最终需达到治疗等效、临床可替代,因此参比制剂对于在美国申报 ANDA 至关重要[9-10]。
3.1 参比制剂( reference listed drug,RLD) 与标准制剂( reference standard,RS) 介绍
RLD 是指由美国 FDA 发布的橙皮书( Oranger Book) 中列出的药品( listed drug) ,作为仿制药或者改衣型新药申请者申报 ANDA 时的参照。RS 是仿制药申请人在申报 ANDA 时,需要进行体内生物等效性试验必须采用的对照品。
3.2 RLD 选择原则和路径
美国 FDA 选择 RLD 的原则是基于安全性和有效性的完整临床研究,根据《联邦食品药品化妆品法案( Federal Food,Drug and Cosmetic Act,FDCA 法案) 》第 505( c) 条批准新药申请( new drug applica-tions,NDAs) 的药品。美国 FDCA 法案的 505 部分规定药品申报类型有: 505( b) ( 1) 节,适用于新药申报; 505( b) ( 2) 节,适用于改良型新药申报; 505( j)节,适用于仿制药申报。美国 FDA 选择 RLD 的原则为: ① 基于经 505( b) ( 1) 批准的新药具有完整的安全有效性数据以及完整的说明书信息,美国 FDA优先考虑该类新药作为 RLD。② 如果在 505 ( b)( 1) 和 505( b) ( 2) 批准了同品种药品的情况下,美国 FDA 一般不选择 505 ( b) ( 2) 批准的药品作为RLD; 如果 505( b) ( 1) 和 505( b) ( 2) 批准的同品种药品有所不同( 如适应证) ,美国 FDA 会考虑将 505( b) ( 2) 批准的药品作为新增的 RLD[11]。
美国 RLD 选择确定路径有 2 条: ① 由美国FDA 在橙皮书中主动指定 RLD。② 如果美国 FDA未指定申请人拟仿制品种的 RLD,申请人可以向美国 FDA 提出书面申请要求指定特定的品种为 RLD。如果美国 FDA 已经指定了一个 RLD,申请人拟参照的药品也具有 RLD 地位( 通过 FDCA 法案 505( c)条批准的药品) 并且与已指定的 RLD 药学等效,申请人也可以向美国 FDA 提出书面申请要求指定另一个 RLD。如果仿制药申请人拟参照与已指定的RLD 进行 ANDA 申报上市,但拟申报仿制药与 RLD有所不同( 如复方制剂中一种活性成分不同、给药途径不同、剂型规格不同等) ,仿制药申请人需根据21CFR314. 93( petition to request a change from a lis-ted drug) [12]要求,提交公民请愿( citizen petition) ,美国 FDA 会在提交请愿后 90d 内做出批准或者不批准的决定,只有获得美国 FDA 的批准后,申请人方可继续采取所选的 RLD 提交仿制药申请。
3.3 RS 的选择原则和路径
美国 FDA 要求 ANDA 申请人提供信息证明其产品与 RLD 或 RS 间的生物等效性。除非该药品不存在已知或潜在的生物等效性问题( 此类品种在美国橙皮书中以治疗等效性评价代码 AA,AN,AO,AP或 AT 标识) ,那么申请人就需要通过充分的体内研究( in vivo studies) 或/和体外研究( in vitro studies)方法来证明该药品的生物等效性。RS 是 ANDA 用于体内生物等效性研究所使用的对照品。
美国 FDA 通常选择 RLD 作为 RS( 即 NDA RS) ,如果 RLD 有多个规格,一般情况下选择最大规格的RLD 作为 RS。ANDA 申请人在体内生物等效性研究时,也可以使用 RLD/RS 的授权仿制药( author-ized generics,AGs) 。当 RLD 因非安全有效性原因撤市或者停止销售时,美国 FDA 通常会选择一个参照 RLD 批准的 ANDA 作为 RS( 即 ANDA RS) 。如果存在多个与已撤市 RLD 生物等效的仿制药,美国FDA 通常会将市场销量最高的仿制药指定为 RS。
美国 FDA 在下列条件下会主动考虑重新指定RS: RLD/RS 药品非因安全性有效性撤市、重新选择一个 RS 有助于解决特定药品市场短缺问题、已有的 RS 不能满足市场需求( 即使已有的 RS 尚未撤市) 、备选 RS 的剂量规格不能满足所有 RLD 规格的使用。
同时,仿制药申请人在选择和使用 RS 过程中,在下列情况下也可以主动要求美国 FDA 重新指定RS: ① 美国 FDA 未指定 RS。② 当 RS 在橙皮书上被标记为已撤市且美国 FDA 尚未重新选择同品种的RS。③ 申请人认为除已指定的RS 外有更合适的RS。④ 已指定的RS 在市场上可获得性差,影响申请人做 BE 试验。一旦美国 FDA 指定了新的RS,即使原来的RS( 如已撤市 RLD) 恢复上市,通常仍保留新选定的药品 RS 地位[13]。
3.4 美国 RLD 的动态管理
美国橙皮书是批准药品信息的数据库,除收录基于 FD&CA 法案批准的具有治疗等效性的已批准药品信息,也是参比制剂信息的权威来源。橙皮书是由 美 国 FDA 药品审评和研究中心 ( Center forDrug Evaluation and Research,CDER) 下属仿制药办公室( Office of Generic Drug,OGD) 的专门机构负责维护。RLD 和 RS 是作为美国橙皮书中收载的药品信息的一部分。从药品全生命周期角度看,上市后药品会有原辅料、生产工艺、质量标准乃至生产场地的变更,同时各种商业运作行为如企业间的合并重组等也可能引起包括 RLD 和/或 RS 在内信息的变化[14]。
因此,为保证橙皮书收录信息的准确性和权威性,美国 FDA 对药品信息进行科学管理更新。印刷出版的橙皮书在每年发行 1 次,现行版本为第 42版[15],同时,美国 FDA 还以每月出版橙皮书的积累增刊( Orange Book Current Cumulative Supplement)形式,将当年积累的药品信息按月更新发表,更新的内容或更改代码包括新批准的药品( new drug productapproval,NEWA) 、持证商变更( applicant holder firmhas changed,CAHN) 、停止销售( discontinued,DISC) 、重新销售( change. the product is moved from the dis-continued section due to a change in marketing status,CMFD) 、RLD 变 更 ( change. reference listed drug,CRLD) 、RS 变更( change. reference standard,CHRS) 、商品名变更( change. trade name,CTNA) 等; 网页版的橙皮书每日、每半月、每月和每年更新 1 次( 见表1) 。美国 FDA 对美国橙皮书的动态管理也实现了对 RLD 的动态管理[16 - 17]。
四、中美RLD选择管理的异同
4.1RLD 选择的背景、范围和意义
《药品价格竞争与专利期补偿法案( Drug Price Competition and Patent Term Restoration Act) 》( 1984年) 的第 I 编对 FDCA 法案第 505 节进行修正而创立了 505( j) 简化 ANDA 批准路径,允许在生物等效的基础上批准仿制药作为 RLD 的等效产品[18],该路径所使用的 RLD 来源为美国橙皮书,即美国只选择本国上市的药品作为 RLD。我国历史上较长一段时间,国内的仿制药是指仿已有国家标准的药品,因此并未发布/指定 RLD。我国 RLD 的遴选的最初目的是服务仿制药质量和疗效一致性评价工作,随着化学药品新注册分类改革的推进,新化学药品注册分类要求仿制药与 RLD 质量和疗效一致[19]。高质量 RLD 成就高质量仿制药,同 WHO 一致,我国在全球范围内选择最优的 RLD[20- 21],即除选用国内上市的原研药品、原研地产化产品作为 RLD 外,也选用国外上市国内未上市的原研药品作为 RLD,这些未进口 RLD 主要来自于美国、欧盟和日本等严格的药品监管国家或地区。
在美国,非原研化学药品除了可以通过 FDCA法案 505( j) 路径上市外,也可以通过非处方药专论程序( OTC drug monograph process) 上市[22],目前,我国没有类似的非处方药专论程序,非原研化学药品只能通过新化学药品注册分类 3,4 类进行申报,按照法规要求,此类药品需要与 RLD 质量和疗效一致,因此化药品种对应的“RLD 的有无”和“已发布RLD 的可及性”的状态直接影响着我国非原研化学药品的研发申报,而其中部分“无 RLD”OTC 品种在美国可通过非处方药专论程序上市,如咖啡因片、聚乙烯醇滴眼液等。
4.2 RLD 选择的原则
美国 RLD 的选择标准是基于安全性和有效性的完整临床研究,根据 FDCA 法案第 505( c) 条批准的 NDAs。RS 是进行体内生物等效性试验必须采用的对照品,包括 NDA RS 和 ANDA RS,前者一般指大规格的 RLD,因此 RS 不是 RLD,RS 不等于 RLD。我国 RLD 遴选的原则是首选国际原研药品,其次是选国际公认的同种药品,从字面上看,美国的 RLD等于我国的原研药品,但我国原研药品的定义在关注拟申请的 RLD 具有完整和充分的安全性、有效性数据的同时,也关注境内外首个获准上市,因此从严格意义上看美国 RLD 不等于我国的原研药品; 根据目前 RLD 发布情况看,美国的 ANDA RS 可遴选为国际公认的同种药品 RLD 如左氧氟沙星口服溶液( 发布序号为 53 ~ 24) 。美国在 RLD/RS 非因安全有效性原因撤市或者停止销售,且原研药品在欧盟、日本等其他监管体系完善的国家或地区尚可及时,选择国内 ANDA 上市的仿制药作为 RS,而按照我国遴选原则,原研药品在美国、欧盟和日本等国家/地区不可及时方可遴选国际公认的获得 RLD 地位的仿制药作为 RLD。目前我国对 RLD 的选择首先严格把握“原研”的原则,在根本上为我国提供高质量仿制药奠定了基础。
4.3 RLD 的动态管理
RLD 的动态管理本质上是 RLD 的科学选择和及时调整,具体为 RLD 的选择指定、已发布/指定的RLD 非因安全有效性原因而市场不可及后新的RLD 的选择指定、已发布 RLD 存在安全性、有效性和质量可控性风险,经风险获益评估而终止或暂停其 RLD 身份、已发布 RLD 的信息更新,如持证商、商品名等; 形式上体现为 RLD 在信息载体上更新的情况和更新的速度。我国与美国均对 RLD 实行动态管理,美国 FDA 在橙皮书数据库的基础上,以出版橙皮书的积累增刊的形式,将当年积累的药品信息等按月更新发表,同时在电子版橙皮书( ElectronicOrange Book,EOB) 中进行更新; 我国对已公布的RLD 目录采取滚动更新方式,在已发布 RLD 品种持证商发生变更、药品通用名称发生更新( 尚未在国内上市品种经药典委核准) 等情况时,将根据具体情况于后续发布的 RLD 批目录中予以更新。
五、讨论
5.1 探索建立我国化学药品 OTC 专论制度
OTC 产品既包括中药,也包括化学药品,美国部分化学药品 OTC 可采用专论程序上市,该项举措既有利于节约审评资源、提高监管效率、加快 OTC药物上市速度,也可以满足公众对于 OTC 药物的需求。2020 年 7 月药审中心公开征求《化学药品非处方药上市注册技术指导原则( 征求意见稿) 》意见,基于我国 OTC 注册申报特点,制定化学药品 OTC上市许可申请的技术要求,其中“( 一) 药学研究”部分指出“对于 RLD 已公示认可的品种,应开展与RLD 的药学对比研究。考虑到部分非处方药上市时间较早,质量研究不充分,质量控制的部分指标或限度以现行技术要求为评价标准。对于难以明确RLD 的非处方药品种,在认可临床价值( 临床需求)的前提下,可采用质量提升方式开展仿制药评价”。目前我国化学药品 OTC 注册管理体系尚未完善,按照处方药的工作程序和技术要求,制约着化学药品OTC 注册申报和审评审批进度,许多化学药品 OTC的 RLD 难以确定,由于审评资源和监管资源有限,增加了审评的压力,加重了行政审批的资源负担[23]。未来我国应进一步完善化学药品 OTC 管理的注册路径、审评程序和配套政策,这在解决部分OTC 品种研发申报困难的同时,也可有效减少仿制药企业对此类品种 RLD 的无意义备案申请。
5.2 无 RLD 与 RLD 不可及的概念界定
笔者认为“无 RLD”是指在不考虑拟申请 RLD可及性的前提下,自始至终都无法找到符合现行RLD 遴选原则的部分化学药品,如咖啡因片、维生素 C 片等 OTC 品种,在美国部分“无 RLD”OTC 品种可通过非处方药专论程序上市。同时,有部分品种国内按化学药品进行管理而国外( 部分) 国家或地区按照医疗器械( 如玻璃酸钠滴眼液) 、膳食补充剂( 如硫酸氨基葡萄糖胶囊) 或特殊医学用途配方食品( 如肠内营养乳剂/粉剂) 进行管理,此类品种是否需要遴选 RLD 和有无 RLD 值得思考。
“RLD 不可及”是指已发布的 RLD 因商业原因无法获得,可分为 3 种情形: ① 有满足遴选原则的新的原研药品 RLD,如已发布的美国橙皮书的原研药品 RLD 不可及,选择欧盟或日本的原研药品作为RLD。② 已发布的中国和/或美国和/或欧盟和/或日本原研药品 RLD 不可及,可选择美国橙皮书的ANDA RS 作为国际公认的同种药品 RLD,例如盐酸伐地那非口崩片( 发布序号为 61~39) 。③ 已发布的原研 RLD 和/或国际公认的同种药品 RLD 皆不可及,按照目前 RLD 遴选原则,没有新的 RLD 可供选择,例如硝普钠注射液,此类情形是 RLD 真正的不可及。
在既定的 RLD 遴选原则下,随着时间推移,大部分 RLD 品种将会经历情形①、情形②和情形③,即从 RLD 可及到 RLD 真正不可及。当 RLD 真正不可及时会导致企业客观上无法获得生物等效性试验所需对照品。在美国为了满足仿制药企业做生物等效性试验的需求,在 RLD/RS 和/或 ANDA RS 不可及时,会及时指定( 新的) 国内上市 ANDA RS。因此未来在 RLD 不可及时,我们或可借鉴美国,选择国内上市的高质量仿制药作为生物等效性试验对照品。
5.3 科学选择 RLD
RLD 的遴选是最严谨的审评事项,需以申请人提交的规范、完整 RLD 申请资料为基础,以各专业技术审评为支撑,对拟申请 RLD 的安全、有效和质量可控性进行严格把关[24]。目前我国未进口 RLD占比 74% ,因此,对于未进口药品 RLD 选择和管理,一方面需申请人在全面了解拟申请品种的上市背景、安全性及有效性数据、上市后药物不良反应监测和风险获益评估情况、以及拟申请品种生产企业GMP 符合性情况[25]的基础上进行选择,此外,如企业选择已发布的此类未进口 RLD 开展仿制药研究除满足其质量要求外,还需满足现行版《中华人民共和国药典》和相关指导原则要求; 另一方面,监管机构需对此类产品 RLD 的选择和发布后的管理予以重点关注,如部分未进口 RLD 可能在上市国因安全或有效性原因撤市,需考虑对 RLD 进行调整,以促进仿制药的高质量发展。此外,按照目前注册管理办法,仿制国外上市国内尚未上市的品种,按照 3类仿制药申报,部分品种是需要开展临床试验,后续该类完成了临床试验的 3 类品种是否具有 RLD 地位或是否可以作为对照药品,值得进一步思考。
5.4 完善 RLD 目录的动态管理体系
截至 2022 年 9 月,我国 RLD 目录已公示 1 ~ 62批、已发布 1 ~ 57 批,已发布的 RLD 的勘误信息近400 条。我国对已公布的 RLD 目录采取每批滚动更新的方式,今后,随着已发布 RLD 目录品种信息修订、更新或调整需求的增加,可借鉴美国橙皮书药品信息更新管理模式,统一纳入数据库进行管理,同时也需进一步探索与我国《新批准上市以及通过仿制药质量和疗效一致性评价的化学药品目录集》的衔接。
我国化学仿制药 RLD 的遴选工作经历了从无到有、不断完善的发展阶段,RLD 的科学选择与动态管理有效地推动了我国化学仿制药一致性评价工作的进程和新注册分类化学仿制药的研发。美国化学药品申报路径和仿制药 RLD 选择管理体系相对完善,本文详细介绍并对比了中美化学仿制药 RLD的遴选工作背景、遴选原则和动态管理模式,并在化学药品的注册路径、RLD 相关的概念界定和 RLD 的选择管理等方面提出一些思考。未来在仿制药审评审批和仿制药质量和疗效一致性评价工作中,完善法规体系和注册路径、加强对 RLD 的科学动态化管理和更新、建设有关数据库,应作为今后 RLD 遴选与管理工作关注的方向。