今日头条
海思科EGFR靶向PROTAC报IND。海思科自主研发的1类化药HSK40118片的临床试验申请获CDE受理。HSK40118是一款EGFR-PROTAC小分子抗肿瘤药物,是该公司Protac研发平台筛选出的第二款新药,由靶向EGFR蛋白的小分子抑制剂、E3泛素连接酶的招募配体和连接这两个部分的linker组成的三联体。该新药拟开发用于治疗EGFR突变的晚期非小细胞肺癌。
国内药讯
1.首个国产ECMO医疗器械获批上市。1月4日,国家药监局应急批准深圳汉诺医疗科技开发的体外心肺支持辅助设备、一次性使用膜式氧合器套包注册申请,二者配合使用,用于急性呼吸衰竭或急性心肺功能衰竭、其他治疗方法难以控制并有可预见的病情持续恶化或死亡风险的成人患者。这也是我国首个体外膜肺氧合治疗(ECMO)设备和耗材套包,具有自主知识产权,性能指标基本达到国际同类产品水平。
2.捷思英达启动ERK抑制剂联合用药临床。捷思英达宣布ERK抑制剂JSI-1187的临床开发在美国已进展至Ⅰ期剂量递增阶段,联合BRAF抑制剂达拉非尼开展针对已确诊携带BRAF V600E/K突变的局部晚期或转移性实体瘤患者的扩展研究。ERK信号的重新激活是患者产生获得性耐药的关键。ERK/BRAF抑制剂联合治疗有可能提供一种有针对性的方法,来延迟或克服患者的耐药性。
3.渤健引进帕金森病新药启动临床。渤健从Denali Therapeutics引进的小分子LRRK2抑制剂BIIB122(DNL151)登记启动一项国际(含中国)Ⅱb期临床,评估减缓30至80岁早期金森病受试者疾病恶化的有效性与安全性。计划在国际入组640人,在中国入组9人。该项研究的中国部分由北京医院主任医师陈海波医生担任主要研究者。BIIB122旨在抑制LRRK2活性以恢复溶酶体的功能,该新药在海外已处于Ⅲ期临床开发。
4.华药康明溶瘤痘苗病毒获FDA临床批件。华药康明自主研发的溶瘤痘苗病毒产品KM1获FDA批准,将在美国开展用于晚期恶性实体瘤治疗的临床研究。KM1是华药康明申报的首款溶瘤病毒产品,去年9月已获得国家药监局临床默示许可,目前已启动国内针对晚期实体瘤的Ⅰ期临床试验准备工作。华药康明另一主打产品溶瘤腺病毒KMAd1预计2023年第二季度申报IND。
5.映恩生物DITAC授权Adcendo公司。映恩生物宣布与Adcendo ApS公司签订技术许可协议,将其独创的DITAC平台的技术授权给Adcendo公司,用于治疗间叶组织肿瘤的uPARAP ADC项目。基于DITAC设计的ADC产品,可有效和持续地递送毒素至肿瘤内,通过旁观者效应杀伤肿瘤抗原低表达甚至阴性表达的癌细胞。根据协议,映恩生物将获得合作项目的首付款、里程碑后期付款以及相应的分层特许权使用费。
6.药明生物4款抗体药物授权GSK。药明生物宣布与葛兰素史克达成许可协议,授予后者1款处于临床前阶段的TAA/CD3双抗和至多3款处于早期发现阶段的T细胞重定向双抗(TCE)抗体的全球独家研究、开发、生产和商业化权利。根据协议,药明生物将获得4000万美元的首付款,最高达14.6亿美元的里程碑潜在付款,以及产品的销售提成。
国际药讯
1.FIC端粒酶抑制剂血癌Ⅲ期临床积极。Geron公司潜在“first-in-class”端粒酶抑制剂imetelstat在治疗复发/难治性低风险骨髓增生异常综合征(MDS)的Ⅲ期临床达到主要终点和关键次要终点。与安慰组相比,imetelstat显著提高不需要输血的患者比例。第8周和24周时,两组维持不依赖输血的患者比例分别为39.8%vs15.0%,以及28.0%vs3.3%。该公司计划在今年向FDA和欧盟监管机构递交上市申请。
2.TL1A单抗治疗BID的Ⅱb期临床积极。Roivant公司与辉瑞合作开发的TL1A单抗RVT-3101在治疗溃疡性结肠炎(IBD)的Ⅱb期临床(TUSCANY-2)获积极中期结果。数据显示,与安慰剂组相比,RVT-3101组患者的临床缓解率更高(32%vs12%,p=0.01),内镜改善率更高(40%vs19%,p=0.01);在经过生物标志物筛选的患者队列中,接受预期Ⅲ期推荐剂量RVT-3101治疗的患者的临床缓解率为40%(vs10%,p=0.02),内镜改善率为56%(vs10%,p=0.0005)。
3.BLyS/APRIL抑制剂IgA肾病Ⅱb期临床成功。Vera公司开发的BLyS/APRIL双重抑制剂阿塞西普(Atacicept)在治疗免疫球蛋白A肾病(IgAN)的Ⅱb期临床(ORIGIN)达到主要终点。Atacicept治疗组患者第24周时通过UPCR评估的蛋白尿变化与基线相比平均降低31%(p=0.037),其中150mg剂量组的蛋白尿水平与基线相比减少33%(p=00.047)。第36周时,与安慰剂相比,阿塞西普组患者的蛋白尿的进一步减少,肾小球滤过率稳定,致病性Gd-IgA1持续降低。药物的总体耐受性良好。
4.FDA批准DNA口腔矫治器用于OSA。Vivos Therapeutics公司专有的DNA口腔矫治器(日间-夜间装置)获得FDA 510(k)批准,用于治疗轻中度阻塞性睡眠呼吸暂停(OSA)。DNA装置主要通过打开气道,让患者从口呼吸转为鼻呼吸,解决许多人打鼾和/或OSA的根本原因。在一项关于患者对DNA治疗的满意度的研究中,97%的患者达到了预期效果,愿意向朋友推荐这种治疗。
5.Belharra公司与罗氏达成合作协议。Belharra公司宣布完成5000万美元的A轮融资,并与罗氏旗下基因泰克公司达成长期研发合作,利用基于光亲和力(photoaffinity)的化学蛋白组学平台,合作开发非共价、小分子候选药物。Belharra新一代化学蛋白组学平台让筛选过程可以在完整细胞环境中进行,不需要依靠独特的氨基酸进行标记,能够探索整个蛋白组。根据协议,Belharra将获得8000万美元的预付款和高达20亿美元的里程碑付款。
6.GAA酶替代疗法成功治疗庞贝病胎儿。加州大学旧金山分校、杜克大学和渥太华大学联合团队利用GAA酶替代疗法(ERT)成功地治疗了尚在子宫内的患有庞贝病的胎儿。研究团队在这名叫艾拉·巴希尔(Ayla Bashir)的小女孩的母亲怀孕24周时,开始通过脐静脉注射GAA酶来进行治疗。目前,这名小女孩已1岁半,并达到发育里程碑,她的的心脏和肌肉功能正常,且能走路,肌损伤和糖原积累的生物标志物正常。研究成果发表在《新英格兰医学期刊》(NEJM)上。
医药热点
1.中疾控:XBB近期引发大流行可能性极低。针对“XBB.1.5毒株是否会攻击人的肠道?是否会引发二次感染”热点问题,中国疾控中心微信公众号于1月4日发布了该中心病毒病预防控制所专家的释疑文章。专家表示,无证据提示XBB.1.5比其他毒株更容易导致严重的腹泻或胃肠道其他临床表现,我国3个月内由XBB系列变异株引发大规模流行的可能性极低。
2.新型抗肿瘤药物应用原则发布。近日,国家卫健委发布《新型抗肿瘤药物临床应用指导原则(2022年版)》。新版指导原则增加了多种新型抗肿瘤药物。其中,呼吸系统肿瘤用药由原来的26种增加到32种,消化系统肿瘤用药由原来的22种增加到28种,血液肿瘤用药由原来的21种增加到29种,泌尿系统肿瘤用药由11种增加到17种等。该指导原则还增加了不同器官重启免疫治疗注意事项。
3.郑正春任湖北省肿瘤医院党委书记。1月5日上午,湖北省肿瘤医院召开全院干部大会,宣布湖北省卫健委关于省肿瘤医院党委书记任免决定,任命郑正春同志为湖北省肿瘤医院党委书记、党委委员。郑正春表态,将以奋斗者的姿态投入省肿瘤医院的发展,与院长魏少忠同志一起团结带领全院干部职工锐意进取、开拓创新、脚踏实地、埋头苦干,努力以高质量党建引领医院的高质量发展。
评审动态
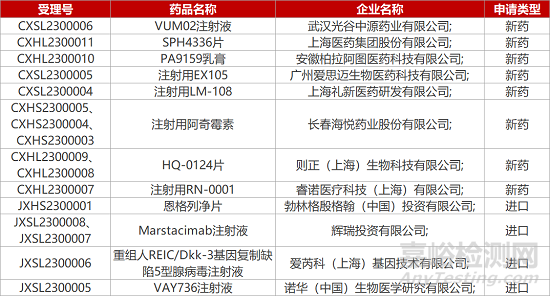
1. CDE新药受理情况(01月05日)
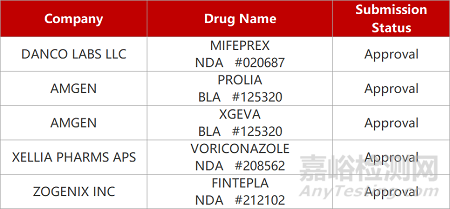
2. FDA新药获批情况(北美01月4日)