摘 要 / Abstract
本文通过对苏合香的基原、产地加工、代用品以及标准相关问题进行整理和研究,对苏合香的标准提出制修订建议;同时对进口药材的质量、标准以及监管问题进行梳理,结合进口药材的管理与应用现状,探讨进口药材的质量管控措施及监管建议,为我国进口药材的发展提供参考。
Based on research of the origin,production and processing,substitutes and quality standards of styrax,this paper puts forward suggestions for the formulation and revision of styrax standards.At the same time,research is conducted on the quality,standards and regulatory issues of imported medicinal materials.Based on the current situation of management and application of imported medicinal materials,the authors provide suggestions for quality control and supervision of imported medicinal materials,hoping to promote development of imported medicinal materials in China.
关 键 词 / Key words
苏合香;基原;质量标准;进口药材;监管
styrax; origin; quality standards; imported medicinal materials; supervision
苏合香作为重要的树脂类药材,自古就是非常有名的进口香药,进入中国已有两千多年,为金缕梅科植物苏合香树Liquidambar orientalis Mill.的树干渗出的香树脂经加工精制而成,为半流动性的浓稠液体[1]。苏合香作为重要的进口药材,主产于土耳其南部、叙利亚等地区,现我国广西、云南亦有引种[2]。《本草纲目》中阐释:“苏合香气香窜,能通诸窍脏腑,故其功能辟一切不正之气[3]。”时至今日,苏合香大多用于配伍开窍止痛之中成药,如苏合香丸、冠心苏合丸、麝香保心丸、十香返生丸、心舒胶囊等。
目前,我国进口药材品种约110种[4],作为中药材资源的重要组成部分,同时也是中医临床用药调剂和制剂不可缺少的重要部分[5],随着中药产业及中药制剂工业的飞速发展,人民群众消费水平的提高和保健理念的增强,其进口贸易体量增速迅猛,其中进口金额较多的品种有龙眼肉、甘草、人参、乳香、没药及血竭等[6-7]。随着进口药材贸易体量的增加,其市场供应一方面受国际环境影响,一些药材通过非正规途径进入我国,扰乱了市场供应秩序,如乳香、没药、血竭等;另一方面,由于进口渠道的改变以及市场的恶性竞争,生产加工过程不清,掺伪掺假时有发生,现有的进口药材标准体系可能无法对质量下降或不合格药材进行有效检验与监管。
为加强对进口药材的监督管理,解决进口药材乱象,保障进口药材质量,新修订的《进口药材管理办法》(以下简称《办法》)自2020年1月1日起开始实施,全面落实“放、管、服”的改革要求,对进口药材的申请、审批、备案、口岸检验及监管等各方面提出了新的要求。一方面,鼓励药材进口,将审批下沉,简化程序。《办法》取消了“允许药材进口的边境口岸,只能进口该口岸周边国家或者地区所产药材”的限定,促进了优质药材贸易便利化,更便捷地惠及广大制药企业和人民群众;对进口药材实施“首次进口”和“非首次进口”分类管理,公布的最新版《非首次进口药材品种目录》中收录了93 种非首次进口药材品种[8]。对非首次进口药材进口管理进行简化,无需审批,只需备案即可;将首次进口药材的审批和检验权限下放至申请人所在地省级药品监督管理部门和省级药品检验机构。《办法》实施后,预计首次进口药材的审批时间将会缩短至20个工作日,在省级药品监督管理部门即可办理,极大刺激了中药材的进口贸易。另一方面,要严格药材执行标准,加强全过程监管和溯源管理。为落实“四个最严”要求,推进进口药材的管理,保证进口药材质量,《办法》要求标准执行顺序为现行版《中国药典》标准、进口药材标准、其他国家药品标准、省(自治区、直辖市)药材标准;同时,针对无法定标准的进口药材,取消了“无法定标准的进口药材,自拟药材标准”,应按照首次进口药材进行注册申报。这一系列的措施是响应“一带一路”号召,体现“互联互通”精神。
1、苏合香的相关问题和标准修订有关建议
1.1 基原、生产加工问题及代用品研究情况
历版《中国药典》规定“苏合香”为金缕梅科植物苏合香树Liquidambar orientalis Mill.的树干渗出的香树脂经加工精制而成,主要产于土耳其西南部等地。《美国药典》(United States Pharmacopoeia,USP)规定“苏合香”来源于苏合香树Liquidambar orientalis Mill.和同属植物北美枫香Liquidambar styraciflua L.的树脂。其中北美枫香主要产自于中美洲、北美洲的洪都拉斯和墨西哥等地。然而由于资源紧缺,品种濒危,出于环境、健康、文化及国际公约等原因,2011年土耳其海关出口管理制度中明确规定禁止出口目前《中国药典》中规定的苏合香Liquidambar orientalis Mill.品种。
《非首次进口药材品种目录》中规定苏合香的产地为:英国、土耳其、埃及、印度尼西亚。《符合评估审查要求及有传统贸易的国家或地区输华食品目录》规定苏合香的输华国家和产地为:洪都拉斯、新加坡、印度尼西亚和英国。中国食品药品检定研究院中药民族药检定所于2019年对河北省安国市、安徽省亳州市等国内中药材市场以及国外市场流通的“苏合香”进行了调研、样品收集和检测,发现目前市场上大多数“苏合香”产品为北美枫香在洪都拉斯的加工品,一些进口到我国的“苏合香”为了符合《中国药典》苏合香的来源规定,在名称和产地上人为标识“土耳其产苏合香”,且据调研结果可知目前洪都拉斯为全球最大的苏合香生产加工基地。因此,目前我国市场流通的“苏合香”实际上大多来源于北美枫香Liquidambar styraciflua L.。由于本品为植物的树脂加工品,同属植物其树脂成份相近,且各地有不同的采收和加工工艺,因此很难通过其树脂加工品鉴定基原。
枫香树属Liquidambar L.植物归属于金缕梅科(Hamamelidaceae)枫香属亚科(Subfam.Liquidambaroideae Harms)。该属植物共有5个种及1个变种,其中我国有2个种及1个变种,分别为枫香树、缺萼枫香树和山枫香树;小亚细亚的1个种为苏合香树;北美洲及中美洲(如洪都拉斯)均为北美树种名为北美枫香。目前,国内外研究较多的枫香树属植物为枫香树、苏合香树以及北美枫香。国际报道中,在苏合香的基原问题上,诸多文献认为苏合香树Liquidambar orientalis Mill.和同属植物北美枫香Liquidambar styraciflua L.均为苏合香树脂的来源,并对二者的化学成份进行了分析比较[9-13]。在国内的报道中,李蓓等[14]将枫香Liquidambar formosana Hance的系列加工产品(枫香脂生药、精制枫香脂以及枫香脂挥发油)作为苏合香的代用品,并对其进行了药效学评价。通过比较可知,进口苏合香和代用品均能在一定程度上提高小鼠的心肌耐缺氧能力,其中精制枫香脂和枫香脂挥发油的效用最强;精制枫香脂对体外血栓干重的抑制率的作用强于苏合香,并且精制枫香脂及枫香脂挥发油对提高冠脉流量的作用强度及作用维持时间均优于苏合香。
1.2 苏合香的标准收载情况
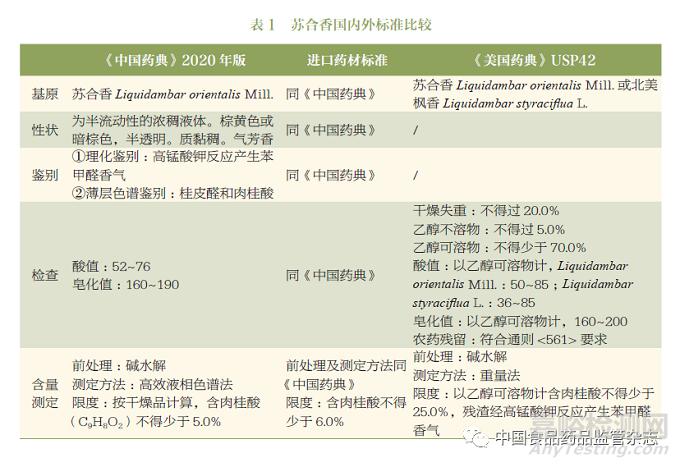
苏合香现收载于《中国药典》2020 年版一部及进口药材标准和《美国药典》USP42。综合来看,主要包括基原、性状、鉴别、检查和含量测定。其中,《中国药典》及进口药材标准基本一致;而《美国药典》较《中国药典》多增加了北美枫香Liquidambar styraciflua L.这一基原;三个标准最大的区别在于含量测定的限度以及测定方法不一致,具体详细信息见表1。
1.3 苏合香标准问题研究及修订建议
从表1可知,三个标准主要的问题在于:①基原;②含量测定指标的专属性以及限度的合理性。
首先,考虑到国内需求和资源利用问题,笔者建议在开展相关研究的基础上,可增加“北美枫香Liquidambar styraciflua L.”作为苏合香的第二基原。
其次,针对标准中含量测定的肉桂酸的限度问题,按照《中国药典》2020年版的含量测定方法,对苏合香样品进行测定法分析,结果发现,碱水解后肉桂酸的含量测定结果均远高于5%的限度要求,因此,目前《中国药典》2020年版的苏合香标准中的肉桂酸的含量限度是值得商榷的。
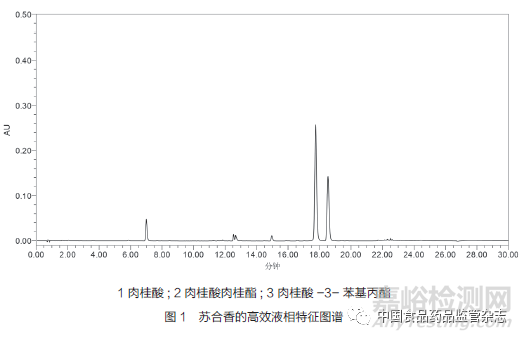
最后,对于标准中含量测定的指标选择问题,上述标准中均采用碱水解的方式测定水解后的总肉桂酸的含量,这种测定转化后的成份而不是选择测定原型成份的做法无法体现苏合香的成份类型,且质控指标单一且专属性不强,可能会出现企业为满足《中国药典》的标准而掺伪掺假。通过对苏合香成份溶解性的研究以及对其物质基础的了解,对苏合香进行了特征图谱的研究,发现肉桂酸、肉桂酸肉桂酯及肉桂酸-3-苯基丙酯等成份是苏合香的代表性化学成份,详见图1。因此,建议综合考虑苏合香标准中含量测定的指标以及前处理方法,增加测定方法的专属性。
2、进口药材的相关问题
2.1 进口药材质量问题
2.1.1 部分品种基原不清,同名异种、同种异地现象突出
因进口药材产地多为其他国家或地区,给基原的确定带来了困难,尤其是部分进口药材多未收入原产国(地区)的药典,使得基原的确定,尤其是同名异种的药材更加无法可依,无据可循。如树脂类药材乳香、没药均属于多来源品种。此外,中药强调产地对药材质量的影响,相关进口药材的批准信息一般只有国家或地区名称而无具体的产地信息。如沉香,同种异地现象严重,沉香产地为印度尼西亚、马来西亚、越南,而这三个国家和地区分布着至少20余种沉香属植物,由于生态环境的不同,使得不同产地的沉香的有效成份存在差异,进而导致药材功效与临床疗效有所区别[15]。
2.1.2 生产过程不明,进口渠道复杂,质量管控困难
中药材全产业链控制涉及诸多环节,对于保证中药产品质量至关重要,其中生产和流通是全产业链的重要环节。目前,我国进口药材质量总体稳定,但个别品种出现了质量下降、不合格率较高等情况。进口药材的生产加工过程一般是由原产国(地区)或中转国(地区)生产加工完成。一方面,一些药材进口国家(地区)生产工艺落后,相关药材标准缺乏,存在对出口产品标准制定不规范、监督不达标等问题,造成加工产品质量良莠不齐。另一方面,由于国内外标准差异、用途差异、生产力水平限制等因素,相关产品生产过程不明,进口渠道复杂,药材到达我国口岸未必能保持其原有的质量水平,尤其是树脂类药材,海关工作人员很难凭借药材外观性状或目前的标准检测确定其产地。且我国药材进口企业以贸易型企业为主,在境外实施生产过程管控和追溯的难度较大。
2.2 进口药材标准问题
药材标准是药材质量检验的重要依据。进口药材质量研究一度成为各口岸药检所技术创新的先导和重要工作,进口药材标准从无到有,从简单到逐步完善,逐渐形成了涵盖性状、鉴别、检查、含量测定的以《中国药典》为主的多层次标准体系。现行进口药材标准主要有:①《中国药典》;②《关于颁布儿茶等43种进口药材质量标准的通知》;③原卫生部颁布的相关暂行标准;④国外药典标准。虽然相关标准已经逐步完善,甚至包括了采用有效成份或指标成份量化控制的检验项目,但是,随着进口药材贸易的蓬勃发展,相关标准的适宜性、专属性以及规范性等受到了极大挑战。
国内外标准差异大,且有些国家和地区生产工艺不发达,相关药材标准缺乏。部分进口药材未被收入到原产国(地区)的药典中,再加上用途差异,使得药材进口时无法有效控制其来源和质量。以进口的乳香、没药和苏合香为例,在一些国家和地区主要被用作香料使用,而在我国常用于芳香开窍、活血止痛的中成药中。
进口药材的标准体系有待更新升级。受仪器、技术条件限制,传统进口药材质控标准颁布年代久远,相对落后,缺乏有效成份或指标成份的量化控制,已经不能有效反映当前进口药材的质量。如朝鲜红参目前仍执行1988年原卫生部标准;高丽红参含量测定仍采用氨基柱分离,蒸发光检测,其操作繁琐,精密度较差。随着进口药材品种和需求的不断变化,尤其是供藏医和维医临床使用的民族药逐年增加,部分进口药材品种虽已被部颁标准收载,但标准颁布实施后一直未修订提高,已不能适应现代医药发展的要求。此外,《非首次进口药材品种目录》中近60%的品种依据2004 年制定的《关于颁布儿茶等43种进口药材质量标准的通知》,该标准执行多年,是否适用目前的情况,有待商榷。如土耳其海关管理规章制度已明确规定禁止出口目前《中国药典》中规定的苏合香品种。因此,苏合香的来源问题如何确定值得思考。
2.3 进口药材的监管问题
目前,进口药材的监管主要由三个部门协调监管,在监管中容易出现法规监管不协调,导致制度障碍等问题。如《符合评估审查要求及有传统贸易的国家或地区输华食品目录》(以下简称《输华目录》)公布了我国检疫准入的 128 种药材品种及对应产出国[6]。国家药监局、海关总署和市场监管总局于2020 年发布了《非首次进口药材品种目录》公布了93个药材品种及对应产地。然而,以上两个目录对中药材品种及对应产地的规定存在不一致,导致部分药材因为检疫准入障碍而无法进口。以《非首次进口药材品种目录》中的“猴枣”为例,《输华目录》中未规定没有检疫准入国家或地区,因此,印度猴枣因未列入《输华目录》而无法进口。进口单位如需进口《输华目录》以外国家或地区的进口药材,需要依法向海关总署申请,才能获得注册准入,这一限制障碍了进口药材品种和进口药材货源地的增加,不利于有价值的传统药材新品种的引进。另外,进口药材的监管面临基原难以确定、生产过程监管困难、边境贸易散乱、政策不适宜、监管力量薄弱等问题。这些问题都对我国进口药材的监管提出了挑战。
3、进口药材质量管控措施及监管建议
3.1 加强源头和生产控制,发展原产国(地区)道地药材基地
中药源头的质量控制是产业健康发展的核心。《国家药监局关于促进中药传承创新发展的实施意见》强调引导促进中药材规范化种植养殖,鼓励中药饮片企业将质量保障体系向种植加工环节延伸,从源头加强质量控制。因此,基于道地性是优质药材质量形成的核心因素,对于进口药材,在原产国(地区)建立道地药材基地,规范性加工生产是确保质量的重要举措[16]。
目前,在现有的贸易和流通模式下,一部分进口药材货源稳定,但另一部分进口药材的货源处于“内忧外患”的状态。要扭转这种局面,缓解药材资源的供需矛盾,在原产国(地区)建立道地药材基地是解决进口药材货源、保障进口药材质量的有效途径。发展原产国(地区)道地药材基地最重要的是保证基原的准确性,规范生产加工技术,保证药材质量,对其全过程进行记录,建立质量追溯系统,从而减少药材基原混乱等情况。通过摸索一套原产国(地区)生产道地药材的全新模式,掌握科学规范的进口药材生产技术,从而减少质量不稳定或劣质药材混入的情况。最终实现降低成本,缓解供需矛盾,扭转目前部分进口药材价格暴涨、质量参差不齐等情况,同时也可以实现中药资源的可持续利用和保护生态环境的需求[17]。
目前,我国已有企业在其他国家或地区实现种植茯苓、养殖海马等;更有企业为国内相关企业提供优质的进口药材原料,在其他国家或地区注册成立相关公司,在当地进行血竭等药材的生产和加工,极大地降低了药材的进口成本保证了药品质量[18]。
2003年世界卫生组织(WHO)提出的《药用植物种植和采集的生产质量管理规范 (GACP) 指南》指明了药物植物原材料和最终产品安全性和质量的决定因素分为内部(基原)和外部(环境、采集方法、栽培采收和采收后加工及运输贮藏过程)两方面,只有通过规范化的种植流程和管理才能提供符合国际市场需要的中药原料。
3.2 推进信息化追溯体系建设,强化溯源管理
药品信息化追溯体系建设是药品监管的新手段、新任务,关系着医药行业的长远发展。《疫苗管理法》规定实行疫苗全程电子追溯制度,新修订《药品管理法》规定国家建立健全药品追溯制度,从法律层面明确了药品追溯制度的法律地位,强调了其必要性以及重要性。信息化追溯体系对于中药材及中药饮片的质控和监管也具有实际意义。
自2020年1月1日起施行的《进口药材管理办法》在进口药材管理上,严格落实“四个最严”要求,严格药材执行的标准,加强溯源管理。明确国家药品监督管理局根据需要,可以对进口药材的产地、初加工等生产现场组织实施境外检查;同时,明确药材进口单位应当协调出口商配合检查。对于进口药材,为推进信息化追溯体系建设的顺利进行,必须要打通国内外的连接通道以及国内各环节之间的相互协调。
做好信息化追溯体系的前端是数据采集与存储。在此阶段,最重要的是打通国内负责进口药材的企业与境外出口商、种植户之间的连接通道。相关企业应提高意识,明确目前国家对从非法渠道进货以及售假的处罚力度,在进口药材时对药材的基原以及生产加工环节进行深入调查,甚至在原产国(地区)建立种植基地,同时采集进口药材基本信息并进行存储,对其进行赋码,以保证进口药材原产国(地区)证明文件的真实性。尤其是不同产地的树脂类药材,涉及多基原品种和复杂多变的加工过程,很难凭借药材外观性状或目前的标准确定其产地。因此,进口企业对进口药材赋予追溯码是保证药材质量的重要环节。
做好信息化追溯体系全流程数据对接与协同。目前,我国对进口药材的监管涉及多个部门。有效解决监管部门之间的数据协同,与进口商之间的数据传递,以及进口商与药品使用、生产方之间的数据对接,可以使进口药材的追溯信息在整个产业链中流动起来,真正实现信息可追溯。如利用追溯码,本着“一物一码,物码同追”的原则,查验进口药材经口岸检验是否合格,核实检验报告书复印件和注明“已抽样”并加盖公章的进口药品通关复印件是否真实等。
开展智慧监管,对进口药材进行赋码、扫码,并逐步在药品生产流通全过程实现可追溯,同时保证追溯数据社会公众可自主查验。最终通过信息平台公开违法违规情形,实现社会共治,真正实现“来源可追、去向可查、责任可究”的目标,切实保障公众用药安全[19]。
3.3 加强国产品牌培育和产品营销,解决供需矛盾
近年来,我国野生中药资源破坏较为严重,一些天然药物资源尤其是国家重点保护的珍惜资源产量相对不足,很多品种开始大量进口,或者在原产国(地区)建设中药材种植基地以补充国内用药需求[20]。这种药材外来输入的现象不仅使一些基原不清、加工方法不详、疗效不明的外来药材扰乱了中药材市场,同时,由于缺乏大样本、可重复数据的支撑,也不能确定其是否可在临床进行替代性应用。此外,一些品种的境外货源,在价格、数量等方面比较占优势,极大地冲击了国内药材的市场份额。我国虽然实现了一些品种的引种,如西洋参等已形成了东北、华北和西北三大栽培产区,但进口西洋参由于具有较高的口碑效应,市场认可度高于国产西洋参,说明我国中药材在品牌培育及产品营销方面还有较大的提升空间。
开发优质中药是中药现代化、国际化发展的前提。一方面,成功引种的胖大海、西洋参、藏红花等药材,解决了我国对于这些药材只能靠进口的问题[21-22]。但是,近 20 年以来,随着药品监管体系的完善,为保证引种药材的质量符合国家标准,具有较好的临床疗效,国家规定引种海外药用植物必须完成植物学、植物化学、药理学和毒理学等一系列完整的研究,需要多学科配合、难度大、周期长[23]。但是针对当前国内市场越来越多短缺药材靠外来输入以满足临床应用的现状,随着科学技术的发展,中药质量控制模式的健全,以及动植物种群生态适宜性分析技术为短缺药材适宜性产地的选择提供参考,国产品牌的培育正走上正轨。以沉香为例,近年来,沉香国际需求急剧增加,针对全世界野生沉香资源濒危、沉香形成机制不清、产业化结香技术缺乏等问题,魏建和[24]等人提出 “白木香防御反应结香假说”,且在此基础上开发了“通体结香技术”[25],采用此技术极大地提高了沉香产量,且结香6个月的沉香药材可满足《中国药典》的规定[26],结香20个月的沉香品质不低于野生沉香[27]。
3.4 规范控制标准定位,推进标准更新升级
要明确药典标准、局(部)颁标准、进口药材标准的定位,按照《进口药材管理办法》的规定,进口药材应当符合国家药品标准。对于标准具有不同来源的品种,其标准执行的先后顺序为:《中国药典》现行版、进口药材标准、其他的国家药品标准、相应的省(自治区、直辖市)药材标准(进口少数民族药材)。同时按药典优先、时间优先、基原优先等原则,明确收载药材的原则、标准修订周期及制修订程序等,及时修订相关药材国家标准,解决同名异种、同种异地等问题。
建议组织建立完整的、动态更新的药材标准数据库。为此,相关监管部门要积极联合科研单位结合各相关品种的基原、生长环境、种植、生产加工、流通以及原产国(地区)的标准、法规、宗教信仰、贸易政策等实际情况,考察检验方法的专属性,检验项目的全面性以及质控指标的科学性、合理性、有效性,提高相关药材标准的规范性及可控性。从而研究制修订进口药材相关国家药品标准,包括部颁藏药、部颁维药、部颁蒙药等进口民族药材标准,并建立共享机制,便于使用和管理,为完善进口药材国家标准体系奠定基础。如2020年版《中国药典》收载的胡黄连为玄参科植物胡黄连 Picrorhiza scrophulariiflora Pennell的干燥根茎;而《关于颁布儿茶等43种进口药材质量标准的通知》规定胡黄连为玄参科植物胡黄连Picrorhiza kurroa Royle ex Benth.或西藏胡黄连Picrorrhiza scrophulariiflora Pennell的干燥根茎,目前,《非首次进口药材品种目录》已将其改为与2020年版《中国药典》一致。因此,以最新版《中国药典》为标准,加强外来输入短缺中药材的质量监管,是保障当前进口药材用药安全的有效途径。
3.5 提高监管法规适宜性,强化联合监管效能
目前,药材进口涉及的法规主要包括三大领域:药品监管相关法规、动植物检疫相关法规、动植物保护相关法规。依据药材进口工作的特点,监管部门分别将原则性法规规定和具体的、可操作的实施性规定相结合,对进口药材进行监管。在多方协调合作监管的过程中,相关监管部门应注意随着中药产业的发展、进口药材资源的变化以及国际形势的动态及时完善与更新监管法规。
为及时完善与更新监管法规,提高监管法规适宜性,提出以下几点建议:①要及时将《符合评估审查要求及有传统贸易的国家或地区输华食品目录》与《非首次进口药材品种目录》进行信息对接,统一并规范两个目录对中药材品种及对应产地的规定,防止部分质量优良药材因为检疫准入等障碍而无法进口。② 要仔细考察并确定相关进口药材批准信息中规定的产地信息,以保证临床所需进口药材为准确基原和产地的品种,解决因无数据、无标准而无法确定其是否可以在临床进行替代性应用,影响临床疗效的问题。
要做好监管部门的协调联动,强化联合监管效能。进口口岸药品监督管理部门对接好进口批件的办理和进口备案工作;海关部门做好对首次向中国输入药材的国家或地区的产品风险分析、监管体系评估,对已有贸易的国家和地区进行回顾性审查。同时,做好进口药材的现场检疫工作。多部门协调监管应建立工作协调机制,避免出现降低监管的标准和效率等情况。①市场监管、海关等部门紧密联合,加强协作,形成部门工作合力,对进出口药品经营进行拉网式监管,督促企业认真履行药品全生命周期管理责任。② 加强行刑衔接,督促药品监管部门和药品检验机构切实承担起药品监管责任,牢牢守住药品安全底线;对进出口药品经营中涉嫌犯罪的案件应移送司法机关,严厉打击。③高度重视边境药品进出口贸易发展,推动地方各级政府强化属地管理责任,扛起药品安全政治责任,营造良好社会氛围,及时回应社会关切。
随着新版《进口药材管理办法》的实施和中医药传承创新发展的推进,以国内需求为主体、国内国际资源相互补充的新发展格局正加快形成。目前,进口药材的监管面临新形势、新机遇、新挑战,伴随着“一带一路”倡议为中医药事业提供的新机遇,在保障人民用药安全的前提下,在我国持续深入推进“放管服”改革背景下,亟需打破制度障碍,提升进口药材贸易便利性,保障进口药材可及性;推进信息化追溯体系建设,保证全产业链的质量追溯;开展进口药材监管规则和标准的改革创新,从而推动我国进口药材监管更加及时高效、系统权威。