您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2022-12-11 19:32
摘 要 Abstract
疫苗国家监管体系的建设完善只有进行时,没有完成时。通过研究我国疫苗政策法规与监管流程,分析健全的疫苗国家监管体系带来的效益,比较不同国家疫苗监管之间的差异,挖掘疫苗从生产到上市后使用过程中出现的经典事件及原因,探究新冠肺炎疫情期间国内外疫苗应急审批机制的重要作用,有利于逐步完善我国疫苗监管法律法规,不断增强药品监管能力,保障疫苗安全、有效、质量可控。
The construction and improvement of the national regulatory system of vaccines is a work in progress, not a finished one. By studying vaccine policies and regulatory processes in China, analyzing the benefits brought by a sound national regulatory system for vaccines, comparing the differences between vaccine regulation in different countries, and digging into the classic events and causes that occur in the process of vaccines from production to post-marketing use, it is conducive to gradually improving China's vaccine regulatory laws and regulations, continuously enhancing drug regulatory capabilities, and ensuring safe, effective, and quality-controlled vaccines.
关键词 Key words
疫苗法规;监管体系;世界卫生组织;国际对比;监管事件
vaccine regulations; regulatory system; World Health Organization; international comparison; regulatory events
近年来,我国药品监管现代化步伐不断加快,药品管理法规体系日渐完善,2019 年6 月、8月分别通过《疫苗管理法》[1]、《药品管理法》[2]。随着智慧监管和监管科学发展逐步深化,药品监管能力加速提升,有利于对疫苗实施全过程、全环节、全方位的严格监管[3]。2022 年8 月23 日,世界卫生组织(World Health Organization,WHO) 宣布,中国通过疫苗国家监管体系(National Regulatory Authority,NRA)评估。这是我国疫苗监管体系先后于2011 年、2014 年两次通过NRA 评估后,在2022 年第三次通过WHO 标准升级后的全面评估。这意味着我国的疫苗监管体系达到WHO 评估标准,对标国际先进水平,具有里程碑意义。疫苗产品的安全性和可靠性事关人民生命健康与公共卫生安全,因此疫苗NRA 仍在与时俱进,不断提升[4]。
本文以落实疫苗全生命周期的监管工作为出发点,对我国疫苗法规和监管进行梳理,并基于国际视角评估我国监管体系,对比国外监管体系的差异,最后分析历史上疫苗监管经典事件和新冠肺炎疫情期间各国疫苗应急审批机制的重要作用,以期对我国疫苗监管法律法规的修改或制定有所启示,促进我国疫苗监管体系更加成熟和国际化。
01.中国疫苗法规和监管
我国是全球最大的疫苗生产国,也是世界上少数依靠自身力量解决全部免疫规划疫苗需求的国家之一。 疫苗关系人民群众生命健康,关系公共卫生安全和国家安全,是国家战略性、公益性产品[5-6]。 党中央、国务院高度重视人民群众用药安全,要求贯彻“四个最严”要求,用“最严谨的标准、最严格的监管、最严厉的处罚、最严肃的问责”加强疫苗监管,坚持风险管理、全程管控、社会共治的原则,建立科学、严格的监督管理制度[7]。 在2001年《药品管理法》第一次修订的基础上,出台了《预防接种异常反应鉴定办法》[8]、《疫苗流通和预防接种管理条例》[9]、《疫苗储存和运输管理规范(2017 年版)》[10]、《预防用疫苗临床可比性研究技术指导原则》[11]。 在2019 年《药品管理法》第二次修订的基础上,出台了《生物制品批签发管理办法》[12]、《国家免疫规划疫苗儿童免疫程序及说明(2021 年版)》[13]、《疫苗生产流通管理规定》[14] 等与疫苗相关的条例、规章及规范。
为了完善疫苗监管长效机制,明确各方责任和义务,《疫苗管理法》已于2019 年6 月29 日第十三届全国人民代表大会常务委员会第十一次会议通过,并于2019 年12 月1 日起实行。 《疫苗管理法》构建了覆盖疫苗全过程和全生命周期的最严格监管制度,这是我国首次就疫苗管理进行综合立法,在世界上也具有开创性的意义。 此外,2019 年4月2 日,国务院发文同意建立疫苗管理部际联席会议制度,由国家市场监督管理总局、国家卫生健康委员会和国家药品监督管理局牵头,统筹研究疫苗产业布局、行业规划、生产流通、质量安全、供应储备、预防接种、补偿赔偿等重大问题, 加快推进疫苗技术创新、工艺优化和产业升级; 定期分析疫苗安全形势, 会商研判疫苗案件办理、信息发布,组织制定疫苗安全事件应急预案; 提出加强和改进疫苗工作的意见, 推进监管能力建设和监管方式创新[15]。
1.1 疫苗研制和注册
通常,疫苗从研发到上市,要历经临床前研究、申报临床、临床试验机构申请和注册临床试验等阶段,一般会经历8 年甚至20 多年漫长的研发过程。
临床前研究:根据每个疫苗情况,选择菌毒株、工艺研究、质量研究,并对制品选择小鼠、豚鼠、兔或猴等进行动物试验。 在初步提示工艺可控、质量稳定及安全有效的前提下, 向国家药品监督管理部门申请进行临床试验。 临床前研究一般需要5~10 年[16]。
申报临床:申请人在提出新药首次药物临床试验申请之前,应向国家药品监督管理局药品审评中心(以下简称药审中心)提出沟通交流会议申请,由药审中心通知申请人是否召开沟通交流会议,并与申请人商议会议时间。 申请人应按沟通交流相关要求按时提交完整的沟通交流会议资料,包括临床试验方案或草案、对已有的药学和非临床研究数据及其他研究数据的完整总结资料。 药审中心对申请人提交的沟通交流会议资料进行初步审评,在沟通交流会议召开至少2 日前,通过“申请人之窗”将初步审评意见和对申请人所提出问题的解答意见告知申请人。 申请人在收到初步审评意见和解答意见后,应尽快反馈问题是否已经得到解决。 申请人认为问题已经解决不需要召开沟通交流会议的,应通过药审中心网站“申请人之窗”告知药审中心取消沟通交流会议申请; 申请人认为申请沟通交流的问题仍未得到解决的, 按原定计划继续组织会议召开。 沟通交流会议由药审中心工作人员主持,双方围绕药物临床试验方案就申请人提出的关键技术问题,以及已有资料和数据是否支持实施临床试验开展和受试者安全风险是否可控进行讨论,并为后续研究提出要求和建议。 现有资料、数据或补充完善后的资料、数据能够支持开展临床试验的,申请人即可在沟通交流会议之后或补充资料和数据后按照相关要求提交新药首次临床试验申请和申报资料。 药审中心在收到申报资料后5 日内完成形式审查。 符合要求或按照规定补正后符合要求的,发出受理通知书,自受理缴费之日起60 日内,未收到药审中心否定或质疑意见的,申请人可以按照提交的方案开展临床试验。 对于已受理的申报资料不符合审评技术要求的,药审中心可通过沟通交流或补充资料方式一次性告知申请人需要补正的全部内容,申请人应在收到补充资料通知之日起5 日内一次性提交补充资料。 申请人补充资料后在该申请受理缴费之日起60 日内未收到药审中心其他否定或质疑意见的,可按照完善后的方案开展临床试验。 申请人未按时限补充资料或补充资料仍不能满足审评要求的,药审中心以暂停临床试验通知书方式通知申请人,并列明目前尚不具备开展临床试验的原因[17]。
临床试验机构申请:企业按规定选择符合要求的临床研究现场和临床研究者,并向监管部门提出一次性疫苗临床试验机构资格认定申请。 疫苗临床试验应当由符合国务院药品监督管理部门和国务院卫生健康主管部门规定条件的三级医疗机构或者省级以上疾病预防控制机构实施或者组织实施。 开展疫苗临床试验应当经伦理委员会审查同意,由国务院药品监督管理部门审核批准。 审慎选择受试者,合理设置受试者群体和年龄组,并根据风险程度采取有效措施,保护受试者合法权益。
注册临床试验:新型疫苗的临床研究包括三阶段的临床试验。 Ⅰ期临床试验初步考察人体安全性,一般受试者为几十例到上百例。 Ⅰ期临床试验结果显示疫苗安全性良好,方可进行Ⅱ期临床试验。 Ⅱ期临床试验主要进行疫苗的剂量探索研究,以及初步的有效性评价并考察进一步扩大人群后的安全性。 一般受试者为几百例到上千例。 Ⅱ期临床试验达到预期目的后,方可进行Ⅲ期临床试验。 Ⅲ期临床试验采用随机、盲法、安慰剂对照(或对照苗)设计,全面评价疫苗的有效性和安全性,一般受试者为几千例到几万例不等。 Ⅲ期临床试验是疫苗上市获得注册批准的基础。 关键性Ⅲ期临床试验获得预期临床保护效果,安全性良好,企业方可将临床数据资料递交国务院药品监督管理部门申报生产。 全部临床试验一般耗时3~8 年,有的甚至长达10 年以上。 每期临床试验都设有严密的安全性监测和严格的终止标准,每个疫苗都可能因为达不到预设目的或预期要求在临床试验期间被叫停,甚至被终止[16]。
完成疫苗临床试验后,企业可向药审中心提供真实、充分、可靠的数据和资料进行审评,审评期间可组织开展临床数据核查。 满足生产条件的企业,将由国家药品监督管理局食品药品审核查验中心组织对企业生产现场进行检查,进行3 批疫苗生产一致性的系统验证,为生产全过程的系统性动态验证,包括从投料开始直至形成最终产品的各个生产环节,并实施全过程控制,对关键中间品进行抽样。 检查组将对3批检查期间的产品进行现场抽样,送中国食品药品检定研究院检定,检定合格后国务院药品监督管理部门将现场动态检查结果、中国食品药品检定研究院检定结果与注册审评意见进行三合一综合评价,对认为安全、有效、工艺真实、质量可控的疫苗予以批准注册申请,同时对疫苗的生产工艺、质量控制标准和说明书、标签予以核准, 并在其网站上及时公布疫苗说明书、标签内容。
1.2 疫苗生产和批签发
国家对疫苗生产实行严于一般药品生产的准入制度。 从事疫苗生产除符合一般药品的生产条件外,还必须具备适度规模和足够的产能储备、具有保证生物安全的制度和设施并符合国家疾病预防控制需要。 疫苗上市许可持有人的法定代表人、主要负责人具有良好的信用记录,生产管理负责人等关键岗位人员具有相关专业背景和从业经历。
疫苗的生产和检验严格按照经核准的生产工艺和质量控制标准,疫苗上市许可持有人应当具备疫苗生产能力; 超出疫苗生产能力范围需要委托生产的,应当经国务院药品监督管理部门批准,符合国家有关规定。 疫苗上市许可持有人按照规定对疫苗生产全过程和疫苗质量进行审核、检验; 采用信息化手段记录生产、检验数据; 确保生产过程持续合法、合规,相关资料和数据真实、完整和可追溯。 按照规定,疫苗生产企业必须对每一批上市疫苗的安全性、有效性等进行全部项目的检验,自检合格后向国家药品监督管理局指定的批签发机构申报批签发。
在国家疫苗管理体系中,批签发作为监管机构对疫苗上市前特别增加的一种监管手段,对上市疫苗的安全有效监管发挥着重要作用。 按照疫苗管理有关规定,每批次疫苗上市销售前或者进口时,应当经国务院药品监督管理部门指定的批签发机构按照相关技术要求进行审核、检验。 符合要求的,发给批签发证明; 不符合要求的,发给不予批签发通知书。 不予批签发的疫苗不得上市销售,并应在药品监督管理部门的监督下销毁。
疫苗批签发通常采取资料审核和样品检验相结合的方式。 由于每批疫苗均要批签发,且检验项目多、耗时长,批签发时对所有项目再进行全部检验是不现实的[18]。 为保证产品能够及时进入市场、满足供应,按照国际通行做法,批签发机构并不需要对每批疫苗进行全检,而是根据风险评估原则,结合产品特性、使用人群、既往批签发历史、GMP 检查情况、产品上市后的不良反应监测结果以及企业诚信度等情况,确定批签发制品检验项目和抽验比例[19]。 批签发机构在具体操作过程中,可以根据品种的工艺及质量控制成熟度、既往批签发等情况进行综合评估,对检验项目和检验频次进行必要调整。 一旦批签发产品出现不合格项目,批签发机构会对后续批次产品的相应项目增加检验频次。
此外,若在批签发过程中发现存在重大质量安全风险的疫苗,由药品监督管理部门对疫苗上市许可持有人进行现场检查,根据检查结果对相关产品或者所有产品不予批签发或者暂停批签发,并责令整改。
公众可在批签发机构网站上查询上市疫苗批签发结果。 批签发公布的信息一般包括:已通过批签发、允许销售的每批疫苗的产品名称、批号、有效期、生产企业、签发日期和签发结论等。
1.3 上市后研究和管理及疫苗的流通和使用
疫苗上市后还要进行扩大人群的Ⅳ期临床研究和观察,对疫苗在更大规模人群的安全性和有效性进行继续评价[16]。 疫苗上市许可持有人应当建立健全疫苗全生命周期质量管理体系,制定并实施疫苗上市后风险管理计划,主动开展上市后研究,对疫苗的安全性、有效性进行进一步确证,并对疫苗进行质量跟踪分析,持续改进生产工艺和质量控制标准,提高工艺稳定性。 对可能影响疫苗安全性、有效性和质量可控性的变更应当进行充分验证,并按规定报请批准、备案或者报告。 对产品设计、生产工艺、安全性或者有效性明显劣于预防、控制同种疾病的其他疫苗品种时,应予以淘汰。 疫苗上市许可持有人根据疫苗上市后研究、异常反应情况等持续更新说明书、标签,并按照规定申请核准或者备案。 此外,国家还通过市场抽检监测疫苗上市后质量情况,药品监督管理部门对包括疫苗在内的生物制品定期组织上市后监督抽验,即从市场流通环节抽取样品,检验疫苗质量[20]。
疫苗采购方式。 国家免疫规划疫苗由国务院卫生健康主管部门会同国务院财政部门等组织集中招标或者统一谈判, 形成并公布中标价格或者成交价格,各省、自治区、直辖市统一采购; 其他疫苗由各省、自治区、直辖市通过省级公共资源交易平台组织采购。
规范疫苗储存和流通。 疫苗上市许可持有人向疾病预防控制机构供应疫苗产品,疾病预防控制机构向接种单位供应疫苗产品。 疾病预防控制机构以外的单位和个人不得向接种单位供应疫苗,接种单位不得接收疾病预防控制机构以外单位和个人供应的疫苗。 疫苗上市许可持有人将疫苗配送至疾病预防控制机构或者疾病预防控制机构指定的接种单位。 疫苗的流通应遵守疫苗储存、运输管理规范,全过程处于规定的温度环境,冷链储存符合要求并定时监测、记录温度,保证疫苗质量,不符合温度控制要求的不能接收或者购进。 依据国家规定,绝大部分疫苗的冷链运输、储存温度需要保持在2~8℃的低温区间内。 过期、包装无法识别、不符合储存和运输要求的疫苗,应采取隔离存放、标注警示标志等措施。
规范疫苗的使用。 预防接种实行居住地管理,儿童离开原居住地期间,由现居住地承担预防接种工作的接种单位负责对其实施接种。 在实施接种前医疗卫生人员需要告知受种者或者其监护人所接种疫苗的品种、作用、禁忌、不良反应以及现场留观等注意事项,询问受种者的健康状况以及是否有接种禁忌等情况,并如实记录告知和询问情况。 预防接种要求完整、准确记录接种信息,包括疫苗的品种、生产企业、最小包装单位的识别信息、有效期、接种时间、实施接种的医疗卫生人员、受种者等内容,确保可追溯,且接种记录应当保存至疫苗有效期满后不少于5 年备查。 免疫规划疫苗的接种不收取任何费用,非免疫规划疫苗的接种除收取疫苗费用外,还可以按规定收取接种服务费。
1.4 预防接种异常反应监测与补偿
《疫苗管理法》《疫苗流通和预防接种管理条例》都对预防接种异常反应作出了明确定义。 预防接种异常反应,是指合格的疫苗在实施规范接种过程中或者实施规范接种后造成受种者机体组织器官、功能损害,相关各方均无过错的药品不良反应。 下列情形不属于预防接种异常反应:①因疫苗本身特性引起的接种后一般反应。 ②因疫苗质量问题给受种者造成的损害。 ③因接种单位违反预防接种工作规范、免疫程序、疫苗使用指导原则、接种方案给受种者造成的损害。 ④受种者在接种时正处于某种疾病的潜伏期或者前驱期,接种后偶合发病。 ⑤受种者有疫苗说明书规定的接种禁忌,在接种前受种者或者其监护人未如实提供受种者的健康状况和接种禁忌等情况,接种后受种者原有疾病急性复发或者病情加重。 ⑥因心理因素发生的个体或者群体的心因性反应。
对于疫苗接种异常反应,我国现已建立疫苗接种异常反应监测报告系统,发生疑似预防接种异常反应的情况立即按规定报告疾病预防控制机构。 疾病预防控制机构组织专家组对疑似预防接种异常反应的情况进行调查诊断,如诊断结果属于预防接种异常反应或者不能排除的,造成受种者死亡、严重残疾或者器官组织损伤的,给予补偿。
预防接种异常反应的具体补偿办法由省、自治区、直辖市人民政府制定。 其中第一类疫苗引起的预防接种异常反应,补偿费用由省、自治区、直辖市人民政府财政部门在预防接种工作经费中安排; 第二类疫苗引起的预防接种异常反应,补偿费用由疫苗上市许可持有人承担。 国家鼓励建立通过商业保险等形式对预防接种异常反应受种者予以补偿的机制[9]。
1.5 保障措施和监督管理
1.5.1 保障措施
县级以上人民政府应当将疫苗安全工作、购买免疫规划疫苗和预防接种工作所需经费纳入本级政府预算,保证国家免疫规划的实施。 国家根据需要对经济欠发达地区的预防接种工作给予适当支持。 省、自治区、直辖市人民政府和设区的市级人民政府应当对经济欠发达地区的县级人民政府开展与预防接种相关的工作给予必要的经费补助。
国务院卫生健康主管部门根据各省、自治区、直辖市国家免疫规划疫苗使用计划,向疫苗上市许可持有人提供国家免疫规划疫苗需求信息,疫苗上市许可持有人根据疫苗需求信息合理安排生产。
疫苗可能出现供应短缺风险时,国务院卫生健康主管部门、国务院药品监督管理部门提出建议,国务院工业和信息化主管部门、国务院财政部门应当采取有效措施,保障疫苗生产供应。
1.5.2 监督管理
明确职责。县级以上地方人民政府对本行政区域的疫苗监管工作负责;药品监督管理部门依法对疫苗的研制、生产、储存、运输以及预防接种中的疫苗质量进行监督检查;卫生健康主管部门依法对国家免疫规划的实施、预防接种活动进行监督检查。药品监督管理部门加强现场检查,向疫苗上市许可持有人派驻检查员。发现假劣疫苗或者质量可疑的疫苗,应当立即停止销售、配送、使用,必要时立即停止生产并上报,由药品监督管理部门对质量可疑的疫苗采取查封、扣押等措施。
全程信息化追溯制度。疫苗上市许可持有人、疾病预防控制机构、接种单位依法建立疫苗追溯体系,如实记录疫苗的流通、使用信息,实现疫苗最小包装单位的生产、储存、运输、使用全过程可追溯。疫苗上市许可持有人按照规定及时在企业网站公示疫苗产品信息、说明书和标签、药品质量管理规范执行情况、批签发情况、产品召回情况、接受检查和处罚情况以及疫苗责任强制保险等信息。
我国实行疫苗安全信息统一公布制度。疫苗安全风险警示、重大疫苗安全事故及调查处理等信息等由国务院药品监督管理部门会同有关部门统一公布。全国疫苗预防接种异常反应报告情况,由国务院卫生健康主管部门会同国务院药品监督管理部门统一公布。国家对于举报疫苗违法行为的人员给予奖励,举报所在企业或者单位严重违法犯罪行为的,查证属实的,给予重奖。
县级以上人民政府制定疫苗安全事件应急预案,对疫苗安全事件分级、处置组织指挥体系与职责、预防预警机制、处置程序、应急保障措施等作出规定。疫苗上市许可持有人制定疫苗安全事件处置方案,定期检查本企业各项防范措施的落实情况,及时消除安全隐患。发生疫苗安全事件时,由疫苗上市许可持有人向省级以上人民政府药品监督管理部门报告;疾病预防控制机构、接种单位、医疗机构向所在地县级以上人民政府卫生健康主管部门、药品监督管理部门报告。药品监督管理部门会同卫生健康主管部门按照应急预案的规定,成立疫苗安全事件处置指挥机构,开展医疗救治、风险控制、调查处理、信息发布等工作,做好补种等善后处置工作。因质量问题造成的疫苗安全事件的补种费用由疫苗上市许可持有人承担。
1.6 法律责任
国家对疫苗管理建立严格的法律责任制度。
一是与一般药品相比,加大对生产、销售假劣疫苗等违法行为处罚力度,提高罚款金额的下限(表1)。《疫苗管理法》明确规定,生产、销售的疫苗如果属于假药,由省级以上人民政府药品监督管理部门没收违法所得和违法生产、销售的疫苗以及专门用于违法生产疫苗的原料、辅料、包装材料、设备等物品,责令停产停业整顿,吊销药品注册证书,直至吊销药品生产许可证等,并处违法生产、销售疫苗货值金额十五倍以上五十倍以下的罚款,货值金额不足五十万元的,按五十万元计算。
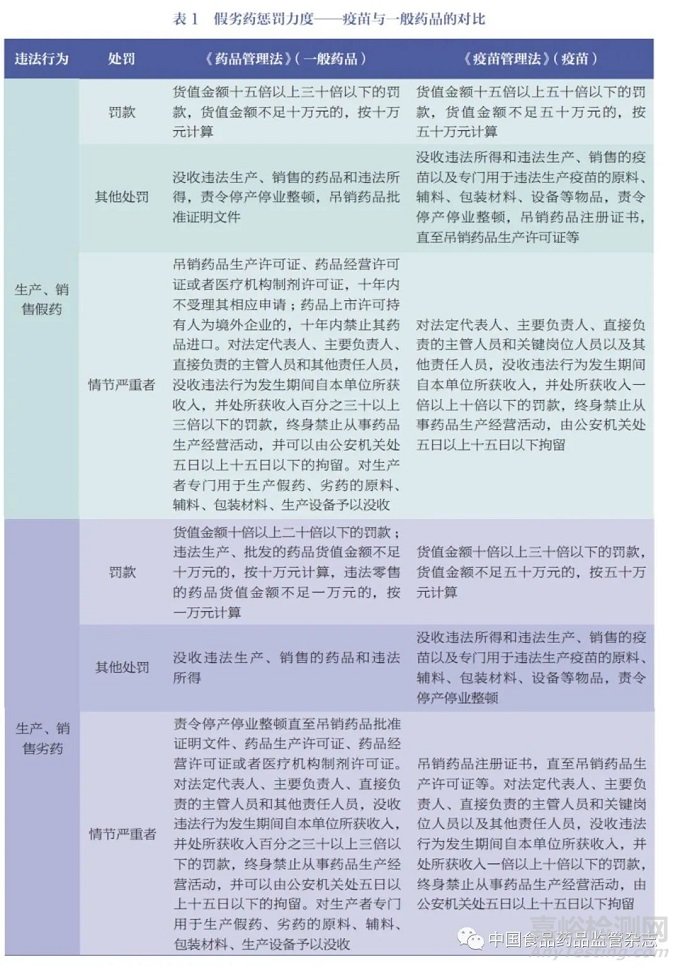
如果生产、销售的疫苗属于劣药,由省级以上人民政府药品监督管理部门没收违法所得和违法生产、销售的疫苗以及专门用于违法生产疫苗的原料、辅料、包装材料、设备等物品,责令停产停业整顿,并处违法生产、销售疫苗货值金额十倍以上三十倍以下的罚款, 货值金额不足五十万元的,按五十万元计算;情节严重的,吊销药品注册证书,直至吊销药品生产许可证等。
生产、销售的疫苗属于假药,或者生产、销售的疫苗属于劣药且情节严重的,由省级以上人民政府药品监督管理部门对法定代表人、主要负责人、直接负责的主管人员和关键岗位人员以及其他责任人员,没收违法行为发生期间自本单位所获收入,并处所获收入一倍以上十倍以下的罚款,终身禁止从事药品生产经营活动,由公安机关处五日以上十五日以下拘留。
二是落实“ 处罚到人” 要求。出现申请疫苗临床试验、注册、批签发提供虚假数据、资料、样品或者有其他欺骗行为;编造生产、检验记录或者更改产品批号;疾病预防控制机构以外的单位或者个人向接种单位供应疫苗;委托生产疫苗未经批准;生产工艺、生产场地、关键设备等发生变更按照规定应当经批准而未经批准;更新疫苗说明书、标签按照规定应当经核准而未经核准等情形之一的,由省级以上人民政府药品监督管理部门没收违法所得和违法生产、销售的疫苗以及专门用于违法生产疫苗的原料、辅料、包装材料、设备等物品,责令停产停业整顿,并处违法生产、销售疫苗货值金额十五倍以上五十倍以下的罚款,货值金额不足五十万元的,按五十万元计算;情节严重的,吊销药品相关批准证明文件,直至吊销药品生产许可证等,对法定代表人、主要负责人、直接负责的主管人员和关键岗位人员以及其他责任人员,没收违法行为发生期间自本单位所获收入,并处所获收入百分之五十以上十倍以下的罚款,十年内直至终身禁止从事药品生产经营活动,由公安机关处五日以上十五日以下拘留。对于疫苗质量问题造成的损害,国家实行疫苗责任强制保险制度,疫苗上市许可持有人应当按照规定投保。因疫苗质量问题造成受种者损害的,保险公司在承保的责任限额内予以赔付。
三是坚持有权必有责,细化处分规定,严肃追究失职的地方人民政府负责人及监管人员的责任。《疫苗管理法》第九十五条规定,药品监督管理部门、卫生健康主管部门等在疫苗监督管理工作中有未履行监督检查职责,或者发现违法行为不及时查处;擅自进行群体性预防接种;瞒报、谎报、缓报、漏报疫苗安全事件;干扰、阻碍对疫苗违法行为或者疫苗安全事件的调查;泄露举报人的信息;接到疑似预防接种异常反应相关报告,未按照规定组织调查、处理;或其他未履行疫苗监督管理职责的行为,造成严重不良影响或者重大损失等情形之一的,对直接负责的主管人员和其他直接责任人员依法给予降级或者撤职处分;情节严重的,依法给予开除处分;造成严重后果的,其主要负责人应当引咎辞职。《疫苗管理法》不仅强调市场主体责任,还建立科学有效的行政权力运行制约和监督体系,对监管部门和地方政府进行责任追究,进而回应社会大众“谁来监督监督者”的问题和担忧。
《疫苗管理法》作为目前全世界第一部综合性的疫苗管理法。无论是立法过程,还是制度设计,都有许多值得关注的亮点。这些亮点可以概括为高、全、新、实、严。
一是“高”。具体体现在:①坚持以人民为中心的发展思想,坚持疫苗产品的战略性和公益性,着力增强广大人民群众的幸福感、获得感和安全感。如国家实行免疫规划制度,免疫规划疫苗由政府免费向居民提供;疫苗出现供应短缺风险时,国家采取有效措施,保障疫苗生产供应;特殊情况下,可以实行疫苗附条件批准和采取紧急授权措施。②《疫苗管理法》明确规定由国家建立或者实行的重要制度近10 项,如国家免疫规划制度、疫苗全程电子追溯制度、对疫苗生产实行严格准入制度、疫苗批签发制度、儿童预防接种证制度、预防接种异常反应补偿制度、疫苗责任强制保险制度、疫苗安全信息统一公布制度等。
二是“全”。《疫苗管理法》“总则”确立了“全程管控”的基本原则。《疫苗管理法》对疫苗的研制和注册、生产和批签发、流通、预防接种、异常反应监测和处理、疫苗上市后管理,按照全生命周期管理的要求,作出了全面而系统的规定。
三是“新”。《疫苗管理法》坚持改革创新,在梳理总结国内外有益经验的基础上,对疫苗管理作出了许多创新性的制度安排。如为加快创新疫苗早日上市,规定国家制定多联多价等新型疫苗的研制规划,组织急需疫苗研制的联合攻关;为应对公共卫生事件,规定了附条件批准、紧急授权使用、批签发豁免等措施;为及时淘汰落后疫苗,规定落后品种淘汰制度;为督促企业强化管理,保证疫苗安全,法律明确了生产管理负责人、质量管理负责人、质量受权人等关键岗位人员的具体要求[21]。
四是“实”。坚持问题导向,着力解决广大人民群众普遍关注的疫苗质量安全、预防接种安全、疫苗损害救济等实际问题。明确对异常反应实行无过错补偿责任;建立疫苗责任强制保险制度,对疫苗质量问题引起的损害,企业通过购买强制责任险的方式,对受害者给予赔偿。
五是“严”。在遵循《药品管理法》一般原则的基础上,《疫苗管理法》对疫苗研制、生产、流通、预防接种作出了一系列特殊的、更严格的规定:①严格的研制管理。对疫苗临床试验实行更加特殊的受试者保护,要求审慎选择受试者,合理设置受试者群体和年龄组;疫苗的临床试验应当由三级医疗机构或者省级以上疾病预防控制机构实施或者组织实施。②严格的生产准入管理。从事疫苗生产活动,除符合《药品管理法》规定的一般要求外,还要具有保证生物安全的制度和设施等。③严格的过程控制。疫苗生产过程要持续符合核准的工艺和质量控制标准;对疫苗实施批签发管理,每批产品上市前应当经过批签发机构的审核、检验;上市后还要持续优化工艺和质量控制标准;对可能影响疫苗安全性、有效性的变更要进行充分验证。④严格的流通配送管控。疫苗由上市许可持有人向疾病预防控制机构供应,疾病预防控制机构向接种单位供应。配送疫苗要严格遵守疫苗储存、运输管理规范,全过程处于规定的温度环境,冷链储存符合要求并实时监测、记录温度,保证疫苗质量。⑤严厉的处罚。对生产、销售假劣疫苗、申请疫苗注册提供虚假数据以及违反相关质量管理规范等违法行为,设置了远比一般药品高的处罚。
《疫苗管理法》全面贯彻“四个最严”的要求,对疫苗实施全过程、全环节、全方位严管,将有力地规范疫苗全生命周期管理,促进我国疫苗质量进一步提升,增强人民群众对疫苗安全的信心。
目前,不论是我国疫苗生产技术,还是对疫苗的监管均已达到了国际水平。自1978 年实施免疫规划以来,我国已经成为世界上少数几个能够依靠自身力量解决全部免疫规划疫苗需求的国家之一。我国生产的疫苗不仅质量得到了国际认可,其技术水平更是受到了世界关注。2013 年10 月,成都生物制品研究所生产的乙脑活疫苗成为我国首个通过WHO 预认证的疫苗;我国研发生产的肠道病毒71 型灭活疫苗(手足口病疫苗)和重组戊型肝炎疫苗也均为全球首创。在疫苗批签发方面,欧美国家的普遍做法是采取以资料审核代替样品检验的方式对疫苗进行批签发,而按照我国《疫苗管理法》的有关规定,每批次疫苗上市销售前或者进口时,都要经国务院药品监督管理部门指定的批签发机构对样品进行相关项目检验,再结合资料审核,确保疫苗质量安全。我国不仅建立起了覆盖疫苗全生命周期的监管体系, 还开创性地出台了专门针对疫苗的综合立法,进一步完善与疫苗工作相关的法制建设。
02.国际疫苗监管体系
2.1 WHO NRA 评估
WHO 对疫苗NRA 的评估,是一项世界范围内公认的、可以科学全面评估一个国家对疫苗监管水平的国际考核。WHO 提出,要保证疫苗质量,必须要建立独立、完善、能有效行使监管职能的体系,即健全的NRA。只有具备WHO 认可的NRA,该国生产的疫苗才能具备申报WHO 预认证的基本资质,进而通过认证被联合国儿童基金会等国际机构列入疫苗采购清单。
自1999 年起,WHO 使用专业评估工具,采取量化指标方式对各国NRA 能力进行评估,评估内容包括7 个板块:国家监管体系、上市许可工作、上市后监管(包括接种异常反应监测)、批签发、实验室管理、监管检查、临床试验监管,覆盖了从疫苗研发到使用的各个环节[22]。7 个板块下共设置183 个分指标,其中关键性分指标88 个。WHO 规定只有88 个关键性分指标全部通过,而且其他非关键性分指标半数以上通过,才能通过评估。
2011 年3 月,我国NRA 首次通过WHO 评估。评估结果显示,有2 个板块获得满分,2 个板块96 分,2 个板块95 分,1个板块89 分。这标志着我国政府对国产疫苗产品高质量的监管,我国疫苗监管体系达到国际标准,中国疫苗首次具备申请WHO 预认证的资质,相当于打开了国产疫苗进入国际市场的大门。WHO预认证是为保证疫苗质量、安全性和有效性达到国际标准而进行的一项评估认证工作。自我国疫苗监管体系通过WHO 评估之后,国内多家疫苗企业紧抓我国NRA通过WHO 评估具备申请预认证的契机,利用优势产品,积极向WHO 申请预认证。2013 年10月,我国首个通过WHO 预认证的疫苗品种——成都生物制品研究所生产的乙脑活疫苗,被列入联合国采购清单。2015 年, 华兰生物工程股份有限公司生产的流感疫苗通过WHO 预认证。随后,2017 年12 月,国药集团中国生物技术股份有限公司旗下北京北生研生物制品有限公司生产的口服二价脊髓灰质炎减毒活疫苗和北京科兴生物制品有限公司生产的甲型肝炎灭活疫苗双双通过WHO 预认证。其中,根据北京科兴生物2018 年披露的年报显示,其海外销售额2017 年为140 万美元、2018 年为1400 多万美元,实现了10 倍的增长,其中大多数的增长来源于甲型肝炎灭活疫苗成功通过预认证带来的机会。WHO 预认证的通过,除了代表该品种疫苗的质量、安全性和有效性合格,还证明该疫苗生产公司的质量管理体系达到了WHO 的要求,相比于其他没有经过预认证疫苗的公司,该公司未获得预认证的疫苗在紧急采购时将会被WHO 优先考虑。
按照WHO 要求,NRA 首次评估通过后3 年内要进行再评估,以考核管理体系的稳定执行和可持续发展。2014 年,WHO对我国疫苗NRA 再次评估。与首次评估相比,再评估标准提高,评估内容更完整,并引入疫苗监管能力“成熟度水平”概念,强化了检查监管机构的持续发展能力,并增加了40 个关键考核指标。在更高评估标准下,我国NRA的7 个板块均以高分顺利通过了WHO 专家组再评估[23]。这标志着我国疫苗监管体系达到国际标准,且具有持续提升监管水平的能力。
随着科学技术和监管实践的发展,WHO 提出的疫苗NRA 能力建设标准也在不断更新,2021年发布第六版全球基准评估工具(Global Benchmarking Tool,GBT),包含9 个板块268 个指标,其中市场监管和机构许可2个板块以及87 个指标为新增部分。新增部分偏重上市后监管,将地方监管机构和能力水平也纳入评估范围,指标实际落实情况的重视程度有所上升[3]。2022 年,WHO 采取全新的全球基准评估工具, 并对国家监管机构进行NRA 成熟度评级(成熟度级别4为最高),在2022 年8 月23 日宣布我国通过NRA 评估,在疫苗制造领域属于“成熟度级别3”。这意味着我国拥有运行稳定、功能良好且完整统一的疫苗监管体系,能够确保在我国生产、进口或流通的疫苗质量可控、安全和有效。
近年来,在WHO 大力支持下,我国药品监督管理部门进一步完善疫苗全环节、全过程的监管制度,严格贯彻国际通行标准的GMP 规范,强化风险管理意识,使得我国疫苗管理体制日趋完善,监管流程不断优化,风险控制能力与日俱增,综合监管水平得到显著增强,疫苗技术研发、企业生产经营水平得到明显提升[24]。在此基础上,我国政府认真履行WHO 成员国责任,积极配合联合国儿童基金会、全球疫苗免疫联盟等国际组织和国际机构,大力支持优秀的国内疫苗生产企业“走出去”,以高效、优质的产品服务于我国及世界其他各国人民的疾病预防事业,为全球疾病控制目标的实现做出应有贡献[25]。
2.2 美国对疫苗的监管
目前美国疫苗的管理主要由美国食品药品监督管理局(Food and Drug Administration,FDA) 的生物制品审评与研究中心(Center for Biologics Evaluation and Research,CBER)负责。疫苗监管机构的变迁如图1 所示。

1972 年, 美国明确规定所有生物制品按《联邦食品药品和化妆品法案》(Federal Food,Drug and Cosmetic Act)的规定进行管理。1973 年,FDA 要求对所有已上市生物制品的安全性、有效性及标签进行再评价;建立疫苗不良事件报告系统(Vaccine Adverse EventReporting System,VAERS),由FDA 和疾病控制与预防中心(Centers for Disease Controland Prevention,CDC) 共同管理。1997 年,《食品药品管理现代化法案》(Food and Drug Administration Amendments) 要求,尽量减少生物制品许可申请和新药申请审评过程中的差异。
根据疾病控制与预防中心规定,一种新疫苗将经历如下6 个步骤才能实现从实验室到达人们身边:①研究开发疫苗。②临床前研发。前两个阶段以动物实验为主,在实验室证明该疫苗有潜力之后,便可以进入临床试验阶段。③ 临床试验, 包括Ⅰ ~ Ⅲ期临床试验。I 期临床试验主要是一小群人(20~100 人)接种疫苗,这一阶段主要关注疫苗有效性、安全性、不良反应、注射剂量与不良反应的关系。Ⅱ期临床试验便会扩大临床研究范围(100~1000 人),向具有新疫苗对应特征(如特定年龄和身体健康状况)的人群接种疫苗,观测疫苗的短期高发不良反应以及疫苗注射剂量与免疫应答反应的关系。Ⅲ期临床试验将进一步扩大临床研究范围(几百至上千人),将新疫苗与安慰剂或其他疫苗对比,测试其有效性和安全性,并确定常见不良反应。④批准与监管。在疫苗被批准后,大部分疫苗还要进行上市后研究,也被称为Ⅳ期临床试验。这是因为当有更多数量与更多类型的人接种疫苗后,可以观察到前三期临床试验无法观察的潜在不良反应,能为疫苗的长期使用决策提供信息。⑤生产疫苗。⑥质量控制。FDA会对每一批次疫苗的有效性、安全性、纯度等方面进行审查,以保证每一批次疫苗的质量。以上便是一个疫苗经历的6 个步骤。其中,疫苗的批准与监管是控制疫苗上市的关键环节。
根据FDA 生物制品审评与研究中心的审批流程,新疫苗的批准上市亦需经过以下6 个步骤:①研究性疫苗提交上市申请。②颁发疫苗临床试验预许可。③生物制品上市许可申请(biologics license application,BLA)。④审查疫苗生产设备。⑤向FDA 的疫苗与相关生物制品外部咨询委员会(Vaccines and Related Biological Products Advisory Committee,VRBPAC) 汇报试验结果。⑥ 产品标签的可用性测试。另外, 在新疫苗获得批准后,FDA 也会继续监督该疫苗的生产, 以确保疫苗安全性。只要疫苗生产商持有疫苗许可证,FDA 就必须持续监测其疫苗质量和生产,包括定期的疫苗生产设备审查等。其上市后监管也包括对疫苗不良事件报告系统提供的数据进行分析,由于疫苗不良事件报告系统所报告的某些不良反应并不一定是疫苗直接造成的,因此专家们会对其进行审查,以提供更多的信息。在专家对疫苗不良事件报告系统提供的疫苗不良反应进行分析时,会使用疾病控制与预防中心的疫苗安全数据链(vaccine safety datalink,VSD)和许可后快速免疫安全监测(post-licensure rapid immunization safe tymonitoring,PRISM) 的数据进行综合分析,以判断该不良反应是否与疫苗接种有关[26]。疫苗安全数据链可以从两个方面帮助专家进行决策。一方面是,专家可回顾医疗记录以分析特定不良反应的发生是否广泛存在于接种者中;另一方面是,可使用快速循环分析(rapid cycle analysis,RCA)系统来探究疫苗接种者在未来是否有更大的概率达到特定健康状态。另外,新疫苗上市后监管还配合临床免疫安全评估项目(clinical immunization safety assessment project,CISA)进行,CISA 将向受种者调查疫苗的安全性,以更好地确保疫苗的安全。疫苗从研发到上市再到上市后监管流程图如图2 所示。
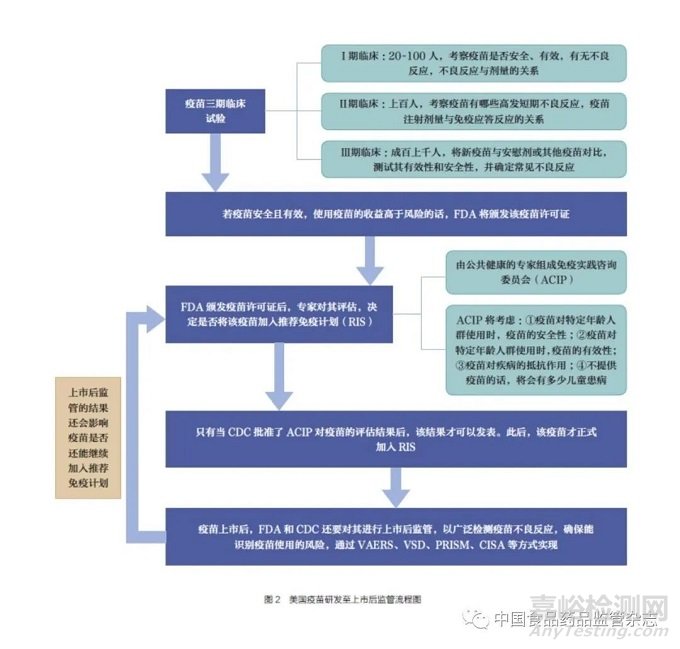
总体来说,美国的疫苗监管有以下四大举措:①实施上市许可制度。新疫苗上市许可申请的审评标准与新药上市申请相似,适用使用者付费制度。FDA 要评估疫苗产品的研制生产方案,根据临床试验结果批准产品上市。②实施批签发制度。FDA 要求疫苗生产商对每批次疫苗进行检验,并自行提交每批次疫苗的有效性、安全性、纯度等检查结果。FDA也进行材料检查和部分项目检验。③实施企业生产许可制度。血液制品(血液和血液成分,包括血浆、血浆衍生物和干细胞)、疫苗和其他自然衍生产品实施企业生产许可制度。④加强对疫苗企业的检查。疫苗生产商要接受FDA定期的生产设备检查,对于生产流程的细微改动甚至是对产品包装的细微改动,都要进行产品变更申报,FDA 要求疫苗生产应及时进行升级,确保为最先进的生产流程。
在疫苗使用之后,若发生了疑似疫苗接种不良反应的,美国建立了赔偿制度。1986 年,美国国会通过了《国家儿童疫苗伤害法案》(National Childhood Vaccine Injury Act)。根据该法案,美国的国家疫苗伤害赔偿计划应运而生。该计划由美国卫生及公共服务部、联邦法院、司法部共同实施管理,以无过错的疫苗接种异常反应作为指导原则,专门用于赔偿接种疫苗而引起的伤害事件,不强调追究哪一方的责任,只要是由于接种疫苗造成的伤害且接种的疫苗被列入补偿计划中,受害者就可以向疫苗法庭(Vaccine Court)提出申请。疫苗法庭便会指派专家对其申请进行评估,以判定该申请是否可以获得赔偿,其经费来源于国家对疫苗征收的特别消费税。该计划在减轻受害者及其家庭负担的同时,也减轻了疫苗生产商的顾虑和负担,保障了疫苗的供应。一般来说,疑似疫苗接种不良反应的赔偿都通过疫苗法庭维权,但由于伤害认定与该赔偿方案都是由美国卫生及公共服务部制定的,这就会出现对疫苗法庭判决结果不满意的情况,这时原告便可对疫苗生产商进行一般的侵权诉讼。需要注意的是,在疫苗法庭上申请赔偿是不需要受害者自付律师费的,而若原告对疫苗生产商进行一般侵权诉讼,一般将会支付赔偿额33% 的律师费。
2.3 欧盟对疫苗的监管
欧洲药品管理局(European Medicines Agency,EMA) 对欧盟的疫苗进行监管,规定在疫苗上市前要经过严格的审批程序以保障疫苗的质量、有效性和安全性。在欧盟,疫苗只有在获得疫苗上市许可后才可在市场上销售。通过临床试验数据评估疫苗的风险收益比来判断是否颁发疫苗上市许可, 评估过程会考虑诸如疫苗质量、有效性和安全性等方面。在颁布上市许可之前,还将对《药品生产质量管理规范》(good manufacturing practices,GMP)、《药物临床试验质量管理规范》(good clinical practice,GCP)、《药物非临床研究质量管理规范》(good laboratory practice,GLP) 等方面进行评测。在疫苗开发过程中,疫苗生产商需对儿童这一人群的疫苗需求进行评估,适当时向EMA 提出儿科临床开发计划(pediatric clinical development program)。若该计划批准后,疫苗生产商必须按照所批准的儿科临床开发计划执行。在提交上市许可申请时,EMA 将会核验疫苗生产商是否按照计划执行,违反计划的话将不予批准上市许可。
欧盟药品注册程序可分为3种:集中注册程序(centralizedregistration procedure)、相互认可注册程序(mutual recognitionprocedure)、国家注册程序( national registration procedure)。疫苗属于强制执行集中注册程序的产品。集中注册程序由EMA 承担,单一注册申请向EMA 提交之后,再交由人用医药产品委员会(Committee for Medicinal Products for Human Use,CHMP) 进行评估,评估的最终决定将由欧盟委员会(European Commission)作出。该决定在整个欧盟、冰岛、列支敦士登和挪威等地均有效。
在疫苗获得上市许可后,每批次疫苗在投入市场前, 疫苗生产商和欧洲官方控制实验室(Official European Control Laboratory)都要再进行质量评估。这一过程将由同属于欧洲理事会(Council of Europe) 的欧洲药典秘书处(European Pharmacopoeia Secretariat)在欧洲药品质量管理局(European Directorate for Quality of Medicines,EDQM)内协调。欧洲药典秘书处还将起草具有约束力的文件,以确保各疫苗生产商之间将有适当质量控制和统一的质量标准,以保证疫苗接种者的安全。此外,各国国家监管机构还会定期检查疫苗生产过程。
疫苗投入市场后,将对其进行上市后监管,主要通过收集疫苗使用后的不良反应,来改善产品安全性、检测在临床试验中不易发现的不良反应。欧洲疾病预防和控制中心(European Centre for Disease Prevention and Control,ECDC)的成立更好地实现了欧盟疫苗上市后的整体监管。
2.4 其他国家对疫苗的监管
英国卫生部对疫苗实施非常严格的监管,疫苗的监管主要由英国卫生部下属的国家医疗服务体系(National Health Service,NHS)负责。英国对疫苗生产商的资质审查也很严格,英国卫生部设有专门的疫苗生产资质审查和管理机构,对疫苗生产商的研制能力、生产设备、资金有近乎严苛的标准。在英国药品行业协会登记的成员有64 家,而其中仅7 家获得了英国卫生部的疫苗生产商资质。
德国的疫苗采购是由其卫生部全权负责,再由卫生部指定的专门负责疫苗物流公司运输到各个州市的接种点。相对疫苗监管的其他环节,疫苗流通领域是最容易出现问题的领域。对此,德国对疫苗运输的设备要求非常严格。德国的疫苗冷链技术已经非常成熟,疫苗专用运输车除驾驶室外全都由特殊的材料制成,具有避光、防热、防静电、防辐射等特点,同时还配有专门的安保人员。
瑞典公共卫生署主要负责疫苗接种和传染病发病的数据收集和汇总,并借助全国统一的医疗登记系统和完善的人口统计系统,联合多家研究机构开展流行病学研究。如果发现某种疫苗在接种率不变的情况下,其所针对疾病的发病率显著升高,则可以从群体层面分析该疫苗有效性是否存在问题。
在加拿大,每个公民都拥有一个全国联网的医疗卡号,接种疫苗时,接种人需要提供自己的医疗卡号。接种的时间、地点、负责接种的医生等数据都会记录在全国联网的医疗信息库中,数据一旦上传则无法更改和删除。当出现疫苗安全问题需要召回时,相关部门就可以根据这个全国联网的数据库快速地将问题疫苗全部召回。如果出现了疫苗伤害事件,有关部门也可以借助数据库的数据进行调查,保障受害者的权益。
03.域外对监管有启示的经典事件
国外关于疫苗管理法律法规的制定与修改,很大程度上来源于已发生的问题与现有法律缺口两者关系的思考,并进一步完善相关法律法规,从而加强监管效率,避免类似问题的再次发生[27]。本节将介绍国外发生的疫苗经典事件、思考该事件对疫苗监管的启示以及促使疫苗监管的法律法规的修改或制定。
3.1 美国马白喉抗毒素与天花疫苗污染事件
1901 年,美国圣路易斯用于接种的马血清白喉抗毒素被破伤风毒素所污染,造成13 名儿童死亡。经调查,事故发生原因是接种的马血清白喉抗毒素是用污染了破伤风毒素的马血清制备的。同年,美国新泽西州有9 名儿童接种了受污染的天花疫苗后死于破伤风。这两个事件直接促使美国国会于1902 年7 月1 日颁布《生物制品控制法》(Biologics Control Act),也称《病毒、血清和毒素管制法》,要求海军医疗服务机构卫生实验室在随后的几年里颁布规章,以确保疫苗的安全、纯度和效价。另外,这件事件的发生促进了美国化学处向化学局转变,这也是FDA 的前身。自1906 年通过《食品和药品法》(Food and Drugs Act)后,FDA增加了管理的职能。
3.2 澳大利亚白喉疫苗事件
1928 年1 月28 日,澳大利亚昆士兰州中部港口城市班德堡的21 名儿童在注射白喉疫苗后,出现了强烈的不良反应,最后直接导致12 名儿童死亡。调查发现,该白喉疫苗质量并无问题,而当时澳大利亚的疫苗采用带有橡胶盖的大剂量瓶包装,一瓶疫苗将被多次开封使用,且在疫苗储存过程中并未冷藏,从而使疫苗受到了金黄色葡萄球菌的污染,导致了该事件的发生。事件发生后,澳大利亚政府对每一位受害者进行了赔偿,并进一步完善了疫苗的管理体系,成立了澳大利亚药品管理局(Therapeutic Goods Administration,TGA), 并于1989 年通过了《医疗用品管理法》(Therapeutic Goods Act 1989)。
该事件的发生说明疫苗储存环节的不规范也会直接影响疫苗的安全。安全的储存不仅要求储存环境的适宜,而且对疫苗的剂型剂量也有要求。如今澳大利亚的疫苗全部采用无菌单剂量小瓶生产,为便于检查浊度,盛装疫苗的瓶子也采用透明玻璃瓶,并设立了严格的冷链储存标准、标签管理条例。澳大利亚政府对于疫苗实行强制使用, 所有的适龄儿童都必须接种疫苗, 并且注射疫苗的费用均由政府承担。在2016 年澳大利亚政府提出“不注射、无补贴”的强硬政策, 澳大利亚的疫苗管理也相对完善。澳大利亚对疫苗供应者、疫苗购买者、医生、疫苗测试参与者,疑似预防接种异常反应(adverse events following immunization,AEFI) 之后的事项、儿童的健康问题以及疫苗的注射时间、地点、品牌等都进行详细的记录,一旦发生问题便有证可循。
3.3 德国吕贝克卡介苗事件
卡介苗(Bacillus Calmette-Guerin,BCG)用于预防结核病,自1921 年开始广泛接种,1928年原国际联盟宣布口服卡介苗安全声明,其安全性得到认可。然而,1930 年发生了不幸的德国吕贝克卡介苗事件,250 名口服了吕贝克市立医院生产的卡介苗新生儿,4~6 周后死亡73 人, 感染结核杆菌者135 人(后期恢复)。这一灾难性的事件,使全世界大为震惊。后来经过20 个月的仔细调查才真相大白,吕贝克市立医院从巴斯德研究所引进了卡介苗菌种,在本医院实验室生产疫苗,但是工作人员误将一株毒力很强的人型结核菌当成卡介苗菌种,因而产生了如此惨痛的后果。调查结果虽然肯定了卡介苗的无害,但人们对卡介苗的安全问题产生了怀疑,曾一度阻碍了卡介苗在欧洲的推广使用。吕贝克卡介苗事件发生后,《药品生产质量管理规范》(good manufacturing practices,GMP)逐渐形成。依照GMP,每批次疫苗在投入市场之前,必须独立测试其有效性、纯度、安全性。另外,配制疫苗环节必须满足GMP。
3.4 美军肝炎事件
1942 年, 在二战时期, 美军采用17D 黄热病减毒活疫苗用于预防黄热病。该疫苗是由MaxTheiler 发明的,其神经毒性相较于Andrew Sellards 和Jean Laigret 开发的French 疫苗来说较小。巴西广泛临床试验均表明其具有免疫原性和安全性,MaxTheiler 也因该疫苗获得了诺贝尔奖。17D 黄热病减毒活疫苗往往以人血清作为疫苗稳定剂,某些批次疫苗中使用的人血清含有乙型肝炎病毒。结果在2500 万接种者中,有大约2.86 万人患上黄疸型肝炎,导致62 名患者死亡,总共大约有30 万肝炎发生( 多数是亚临床和非黄疸类型)。这起事件的调查结果发现,人血清确实会将肝炎病毒传播给受种者,在停用人血清之后,事故便不再发生。该事件发生后,美国将原辅料质量控制纳入质量管理和质量控制中。FDA 规定,在《美国药典》中已经作出质量标准规定的辅料,在新药申报时不需要再提供质量信息,而如果辅料没有收入《美国药典》,全新的辅料则必须提供应用量的安全性数据。
3.5 美国脊髓灰质炎疫苗事件
1955 年4 月, 美国卡特药厂所生产的、用于预防小儿麻痹症的脊髓灰质炎疫苗中的病毒并未完全灭活,疫苗中仍然存有活体病毒,且该情况在疫苗的安全测试中并未被发现。卡特药厂在病毒活性监测技术尚不完善的情况下,不仅上市了该疫苗,还获得了美国卫生及公共服务部的合法授权。当年美国有12 万名儿童接种了该疫苗,结果约有7 万人被感染,最终导致113 名儿童瘫痪,10 名儿童死亡。该事件发生后,卡特药厂无权再生产脊髓灰质炎疫苗,其研究所所长被开除,美国卫生及公共服务部秘书长Hobby 和美国国立卫生研究院主任Sebrell 引咎辞职。
这一疫苗事件源于药品生产过程的疏忽,一方面源于科学技术水平不够,另一方面源于监管存在疏漏,其直接促使了美国疫苗管理制度的进一步完善。1986年,时任美国总统里根签署通过了《国家儿童疫苗伤害法案》,确定疫苗不良事件报告系统、全国疫苗计划办公室(National Vaccine Program Office ,NVPO)以提供全面的报告,公正的建议和专业知识,以识别和应对疫苗系统中的差距,使疫苗更安全、更有效。此外,要求接种点向接种者提供“疫苗信息陈述书”,设立疫苗接种者受害赔偿基金等。《国家儿童疫苗伤害法案》规定从每支疫苗的销售中,缴纳0.75 美元的税收,作为赔偿基金的来源,且该赔偿基于“无过错”原则。该原则被多国遵循,包括中国。该法案还规定,疫苗提供者应在给儿童接种疫苗之前,向父母提供接种疫苗的益处和风险等信息,并保留每次接种疫苗的疫苗生产商名称和批号的书面记录;接种疫苗后,将严重的健康问题纳入儿童的永久性医疗记录;接种联邦疫苗的不良事件要向疫苗不良事件报告系统报告,以制定疫苗信息材料,详细说明现行疫苗的收益和风险,结合疾病控制与预防中心的疫苗安全数据链进行研究,以帮助确定疫苗疑似预防接种异常反应是否与疫苗直接相关。对疫苗上市后人群反应研究,相当于以更大人群样本进行临床实验以检验疫苗的有效性及安全性,通过对大量疑似预防接种异常反应分析,可为决策者提供更多与疫苗有关的信息,帮助决策者进行下一步决策。该法案的公共政策目标是保证充足的疫苗供应,稳定疫苗成本,鼓励研究和开发新的、更安全的疫苗。在疫苗上市后,FDA 也会随时监测市场,一旦发现疫苗存在危险,便可立即责令疫苗生产商将其疫苗召回或下架;疾病控制与预防中心联合各州公共卫生部,给出关于存储温度、开箱方法、冷链选择等具体的疫苗流通方案。
3.6 日本接种疫苗引起的乙型肝炎病毒感染事件
在一次性注射器发明之前,日本儿童大面积疫苗接种时使用玻璃注射器,而且为节省成本,多名接种者常共用针头,增加了交叉感染的风险,有些接种者后来证实由于疫苗接种感染了乙型肝炎病毒。直到1996 年,日本的厚生劳动省大臣才第一次承认国家在这次疫苗接种事件中负有责任,并宣布政府放弃日本法院要求国家予以赔偿的抗诉。2006年6 月16 日,日本最高法院作出判决,日本政府对在1948~1988年由于不卫生针头导致的乙型肝炎病毒感染有不可推卸的责任。《特定乙型肝炎病毒感染者赔偿特别措施法》规定,无症状者赔偿50 万日元;乙肝患者赔偿1250万日元;轻度肝硬化患者赔偿2500 万日元;重度肝硬化、肝癌、死亡者赔偿3600 万日元。2011年1 月,厚生劳动省对40 万名原告进行赔偿,这一起由于疫苗接种造成的乙型肝炎病毒感染诉讼案,日本最高法院判决日本政府赔偿3.2 万亿日元(约合1882亿元人民币),成为日本历史上涉及人数最多、金额最高的国家赔偿案,从而也迎来了日本疫苗管理办法的修订。1996 年,日本政府修改了《药剂法》,规定疫苗接种相关部门有义务遵守医药品实验标准,并在药物上市后继续收集相关信息并上报。1994 年和1999 年,日本《预防接种法》两次就国家责任部分进行修改,采取结果责任原则,规定无论过失如何,只要厚生劳动省大臣能认定损害是由预防接种导致的,都应给予受害人一定补偿,以保障日本民众利益[28]。
04.新冠肺炎疫情期间各国监管机构的疫苗应急审批机制
新冠肺炎疫情期间,各国监管机构的医药产品应急审批制度为应对突发公共卫生事件、满足世界人民急需医药物资保障需求起到重要作用。其中,疫苗作为抗击新冠肺炎的有效武器,获得了审批政策和审批程序的重要支持。对各国疫苗应急审批机制进行对比与分析,有利于进一步完善我国疫苗监管体系,保障疫情急需的疫苗供应与使用,更加有效地应对突发公共事件威胁。
4.1 中国应急审批机制
《疫苗管理法》专门针对疫苗(预防用生物制品)的应急使用制定条款,第二十条第二款规定“出现特别重大突发公共卫生事件或者其他严重威胁公众健康的紧急事件,国务院卫生健康主管部门根据传染病预防、控制需要提出紧急使用疫苗的建议,经国务院药品监督管理部门组织论证同意后可以在一定范围和期限内紧急使用”。新型冠状病毒传染性强,部分患者临床症状严重,且缺乏有效的治疗药物,因此国家鼓励研究机构、企业单位研发新型冠状病毒预防性疫苗,国家药品监督管理局药品审评中心围绕新型冠状病毒预防性疫苗的研发和临床研究制定了多个相关指导原则,如《新型冠状病毒预防用疫苗研发技术指导原则(试行)》《新型冠状病毒预防用疫苗非临床有效性研究与评价技术要点(试行)》等[29]。国家药品监督管理局食品药品审核查验中心也就疫苗的注册现场检查制定《疫苗特别审批注册现场检查预案》[30], 以有序规范、推进疫苗的研发与审批进程[31]。
国家药品监督管理局对防治新冠肺炎所急需的疫苗等医药产品遵守“统一指挥、早期介入、快速高效、科学审批”的总原则,将其纳入特别审批程序,设立特别专家组进行评估和24 小时内作出是否受理的决定;各级药品监督管理部门及相关技术机构短时间内立即开展技术审评、现场核查等工作,申报材料即到即审,注册检验样品即到即检,出现问题有专人沟通交流,不断压缩审评时限,保证安全的前提下争取尽快上市。自抗击新冠肺炎疫情以来,我国的新型冠状病毒疫苗做出积极贡献[32],已有3 个新型冠状病毒疫苗被WHO 纳入紧急使用清单,成为WHO 认证的安全、有效、高质量的疫苗,包括康希诺生物股份公司的5 型腺病毒载体疫苗、国药中生北京公司和北京科兴中维公司的新型冠状病毒灭活疫苗。其中,截至2022年8 月23 日,北京科兴中维公司的新型冠状病毒疫苗作为全球首个获WHO 批准用于低至3 岁儿童的新型冠状病毒灭活疫苗,已在印度尼西亚、泰国、巴西等14 个国家和地区获批用于儿童和青少年接种,累计接种超2.6 亿剂次,为全球超1.3 亿未成年人预防新冠肺炎提供保护。
4.2 国外应急审批机制
美国主要通过紧急状态下医药产品紧急使用授权制度(emergency use authorization,EUA)为疫情冲击下急需使用的疫苗等生物制品、药品和医疗器械开启“绿色通道”。一旦确认国家处于紧急状态,美国卫生及公共服务部建立并常设EUA 工作小组,邀请卫生、医学等相关领域专家对候选医药产品进行认定,并向FDA 提供专家咨询。EUA 的审评由FDA 下属中心组织内部和外部开展,对紧急状态、适应症、安全性等多项指标进行评估,审评时限压缩到数月甚至数周[33]。
澳大利亚药品管理局先后于2017 年6 月和2018 年3 月建立了2 种药品特殊审评制度——优先审评制度和临时批准制度,前者适用于有完整临床数据与实质性证据的药物,而后者则针对仅有初步临床数据的药物。澳大利亚药品管理局组织相关临时部门及专家根据药物治疗疾病的严重程度、与现有药物的对比等评估资格标准,只有获得相应的资格标准才能进行药品注册特殊审评。2 种审评制度均有效地推进了新药注册模式转变,提高审评效率,加快药品上市与使用[34]。
欧盟同样设置了药物加速审评程序,允许申请条件上市许可或特殊情况下上市许可,使公众及时获得临床数据尚不完整但具有重大公共健康利益的新药[35]。加速审评政策规定产品中要含新型活性物质,或经证明该医药产品具有重大治疗、科学或技术创新等,并且应当与公众健康利益相关,提出申请后由EMA 人用医药产品委员会检验和批准。条件上市许可适用范围更广,不仅可用于紧急情况下申请,如新冠肺炎疫情突发事件,也可用于罕见病用药及其他严重使人疲劳或危及生命的药物,审评时间可压缩至150 天左右,临床数据补齐之后可转为标准上市许可。而特殊情况下的上市许可适用由于病例罕见、医学伦理原则等难以获得完整的安全性和有效性数据的药物,通常不能转为标准上市许可。两者均为疫情期间加速疫苗上市与使用发挥重要作用。
05.结 语
本文系统分析了我国疫苗监管体系,发现严格的要求与监督机制贯穿疫苗研发到上市后使用的各个环节,WHO 的3 次NRA评估通过更是对我国疫苗监管体系的肯定。但我国疫苗乃至药品监管体系与发达国家相比仍有差距,梳理WHO、美国、欧盟等国外疫苗监管体系和应急审批机制,其更为完善和严格的审核标准值得学习与参考,疫苗从生产到使用过程中发生的国际典型事件也为我国疫苗监管体系敲响警钟。随着药品生产和流通的全球化进程加速,我国承诺大国担当,新冠肺炎疫情期间积极推进疫苗国际合作进程,不断促进药品监管体系从立足国内到面向国际,努力实现国际化与先进化。

来源:中国食品药品监管杂志


