您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-09-05 11:39
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
国内药讯
1.拜耳「利伐沙班」新适应症在华获批。拜耳利伐沙班新适应症获国家药监局批准,用于接受外周(下肢)血管重建术(外科手术或血管内治疗操作)的外周动脉疾病(PAD)患者,以降低主要血栓性血管事件的风险。利伐沙班是一种高选择性Xa抑制剂,此前已获批用于择期髋关节或膝关节置换手术成年患者预防静脉血栓形成、成人静脉血栓形成、非瓣膜性房颤成年患者、慢性冠状动脉疾病或外周动脉疾病患者等适应症。
2.石药长效GLP-1受体激动剂获批2项临床。石药集团从天境生物引进的1类新药TG103注射液获得国家药监局两项新的临床试验默示许可,拟开发分别用于阿尔茨海默病和非酒精性脂肪性肝炎(NASH)。TG103是一种注射用长效重组GLP-1Fc融合蛋白,可实现每周一次或每两周一次的皮下给药。该新药此前已获批开展针对超重/肥胖和2型糖尿病的临床试验。石药集团拥有TG103在中国大陆所有适应症开发与商业化的独家权利。
3.上海医药CD20单抗获批膜性肾病临床。上海医药自主研发的重组抗CD20人源化单克隆抗体皮下注射液(B007)新适应症获国家药监局临床许可,拟用于治疗原发性膜性肾病。B007针对CD20阳性的B细胞非霍奇金淋巴瘤适应症的临床开发已于去年11月启动Ia期临床试验,目前正处于Ib期临床阶段。与静脉注射相比,皮下注射给药可大幅缩短给药时间,降低治疗费用,提高用药便捷性和患者满意度。
4.和黄第三代BTK抑制剂报IND。国家药监局受理和黄医药与创响生物合作开发的免疫疾病候选药物IMG-004的I期临床试验申请。IMG-004是和黄医药开发的一款非共价、可逆的第三代BTK抑制剂,具有高效力、高选择性和能通过血脑屏障等特性。该新药今年5月获已获FDA临床许可,适应症为多发性硬化症。目前全球共5款BTK抑制剂获批上市,其中2款来自诺诚健华(奥布替尼)和百济神州(泽布替尼)。
5.礼新GPRC5D-ADC国内报IND。礼新医药1类生物制品注射用LM-305的临床试验申请获CDE受理。LM-305是全球首个进入临床开发阶段的靶向GPRC5D抗体偶联药物,已于今年7月获FDA临床许可,用以评估LM-305在多发性骨髓瘤患者中的安全性、耐受性、药代动力学和初步抗肿瘤活性。目前尚无GPRC5D靶向药获批上市;同靶点进度最快的是强生的Talquetamab,已收获FDA的突破性疗法和孤儿药认定。
国际药讯
1.阿斯利康重磅PD-L1抗体组合获FDA批准。FDA批准阿斯利康PD-L1抗体度伐利尤单抗(Imfinzi)与化疗联用,一线治疗局部晚期或转移性胆道癌(BTC)。在一项Ⅲ期临床TOPAZ-1中,与化疗组相比,度伐利尤单抗组合提高了患者的总生存期(中位OS:12.8个月vs11.5个月)和无进展生存期(中位PFS:7.2个月vs5.7个月),使患者死亡风险降低20%。此前,该疗法已获批用于一线治疗广泛期小细胞肺癌(ES-SCLC),和非小细胞肺癌(NSCLC)。
2.Azurity新型胃酸抑制剂获FDA批准上市。Azurity公司口服悬浮液药品Konvomep获FDA批准上市,用于治疗进行性良性胃溃疡以及减少病危患者上肠胃道出血的风险。Konvomep是由质子泵抑制剂(PPI)omeprazole与碳酸氢钠组合而成。在临床试验中,与一天两次150mg ranitidine活性对照组相比,每天一次40mg omeprazole患者胃溃疡治愈率更高(91.4%vs78.4%,p<0.01)。该新药为吞咽药锭或胶囊有困难的患者带来新的治疗选择。
3.FIC溃疡性结肠炎药物将上Ⅲ期试验。Abivax公司完成约4920万美元的融资,以用于支持其潜在“first-in-class”溃疡性结肠炎(UC)药品obefazimod(ABX464)开展Ⅲ期临床。Obefazimod旨在靶向帽子结合复合物(CBC)上调miR-124的表达,来抑制许多炎症反应介导物的生产。在Ⅱb期临床中,obefazimod(25mg、50mg、100mg)治疗第8周时,显著降低患者调整后的UC症状严重程度指标Mayo分数;其中50mg药物的临床缓解率达到55.3%。
4.勃林格殷格翰IL-36R单抗获FDA批准上市。FDA批准勃林格殷格翰IL-36R单抗Spesolimab(SPEVIGO)上市,用于治疗泛发性脓疱型银屑病(GPP)的发作。这是首款IL-36R单抗获批,也是FDA批准的首款GPP疗法。在一项关键Effisayil 1临床中,SPEVIGO较安慰剂可有效快速地治疗GPP成人患者的急性发作,仅接受一周治疗后,患者没有可见脓疱的比例达到54%(vs6%),而且疗效维持长达12周。在中国,该疗法已被CDE纳入优先审评和突破性治疗品种。
5.诺和诺德11亿美元扩展罕见血液病管线。诺和诺德宣布以11亿美元收购Forma公司,并计划在今年第4季度完成。Forma专注于镰状细胞病和罕见血液疾病的药物研发。根据收购协议,诺和诺德将获得Forma处于II/III期临床阶段、拟用于治疗镰状细胞病的选择性丙酮酸激酶-R(PKR)激活剂Etavopivat,以及在研IDH1选择性抑制剂olutasidenib,以开发用于治疗胶质母细胞瘤、复发/难治型急性髓系白血病、骨髓增生异常综合征和其它IDH1突变实体瘤。
6.儿童囊性纤维化复方获FDA批准。FDA批准Vertex公司囊性纤维化(CF)复方药物ORKAMBI(lumacaftor/ivacaftor)扩展适用范围,此前该药物已被批准用于2岁及以上F508del突变的CF患者,此次将1岁及以上的F508del突变的CF儿科患者全部纳入适用范围。在一项用于1至2岁儿科患者的III期研究中,ORKAMBI耐受性良好,安全性和药代动力学特征与先前研究相似。
医药热点
1.曹雪涛任国家卫健委副主任。9月2日,国家人力资源和社会保障部官网发布一则国务院任免国家工作人员的消息,其中任命曹雪涛为国家卫健委副主任。曹雪涛,男,1964年7月出生,山东济南人,研究生学历,医学博士,毕业于第二军医大学,中国工程院院士、德国科学院院士、美国国家医学科学院院士、美国人文与科学院院士、英国医学科学院院士。此前,曾任中国医学科学院北京协和医学院院校长、南开大学党委副书记、校长等职务。
2.药品网络销售监督管理办法出台。市场监管总局发布《药品网络销售监督管理办法》,自2022年 12月1日起施行。《办法》共6章42条,对药品网络销售管理、平台责任履行、监督检查措施及法律责任作出规定。其中,明确疫苗、血液制品、麻醉药品、精神药品、医疗用毒性药品、放射性药品、药品类易制毒化学品等国家实行特殊管理的药品不得在网络上销售;明确对处方药网络销售实行实名制,强调“先方后药”和处方审核的管理要求。
3.我国拟推进健康码互通互认。9月2日,国家卫健委在新闻发布会上介绍我国卫生健康信息化工作进展与成效。国家卫健委相关负责人表示,目前全国已实现一省一码,赋码数据全国共享,便利群众安全有序出行,助力复工达产;为疫情防控的同时,最大程度便利大家正常通行,正在会同相关部门,不断完善健康码管理,推进健康码互通互认。
4.干细胞首次生成特定人类胚胎细胞。比利时鲁汶大学研究团队在实验室中使用干细胞生成了一种新型人类细胞。新细胞与早期人类胚胎中的天然细胞非常相似,有助于更好地研究胚胎植入子宫后会发生什么。研究结果发表在《细胞·干细胞》上。该细胞模型有望为生育、流产和发育障碍等医学挑战带来更多启示。
评审动态
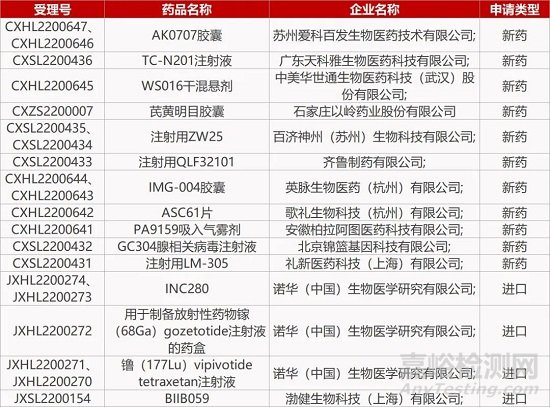
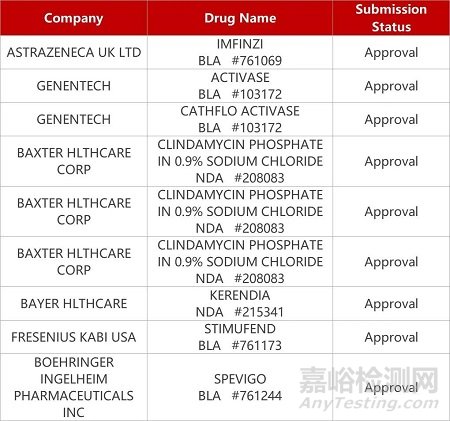
1. CDE新药受理情况(09月04)

来源:药研发


