您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-04-22 11:32
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
WINT公司FIC强心疗法Ⅱ期临床积极。Windtree(WINT)公司具有双重作用机制的潜在“first-in-class”疗法istaroxime,在治疗心源性休克的Ⅱ期临床达主要终点。它可以通过抑制钠/钾离子ATP酶增加心肌收缩力,还可以通过激活肌质网上的SERCA2a钙泵,增强细胞质中的钙再摄取,促进心肌舒张。在该项试验中,与对照组相比,istaroxime治疗组6个小时内收缩压获得显著改善。详细结果将在欧洲心脏病学会心力衰竭会议上公布。
国内药讯
1.李氏引进抗肿瘤新药获批上市。李氏大药厂旗下兆科药业抗肿瘤新药盐酸丙卡巴肼胶囊(Natulan)获国家药监局批准上市,用于治疗晚期霍奇金淋巴瘤。Natulan是一种烷化剂药物,也是一种周期非特异性抗肿瘤药,已在海外获批上市。2018年5月,兆科药业与Leadiant公司签署经销协议,以推进盐酸丙卡巴肼胶囊在大中华地区独家上市。
2.贝达ALK抑制剂启动肺癌辅助治疗III期临床。贝达药业ALK抑制剂「恩沙替尼」登记启动一项新适应症III期临床,评价恩沙替尼对比安慰剂在接受肿瘤完全切除术和标准辅助治疗后的ALK阳性的II-IIIB期非小细胞肺癌患者中的有效性和安全性。该项试验主要研究者由天津市肿瘤医院王长利博士和四川大学华西医院卢铀博士后共同担任。恩沙替尼是目前唯一一款获批上市的国产ALK抑制剂。
3.三叶草新冠疫苗最新临床数据积极。三叶草三聚体重组蛋白新冠疫苗SCB-2019(CpG 1018加铝佐剂)的两项临床新数据积极。在基础免疫接种后约6个月,在无新冠感染史的成人(18-59岁)中,预防重症保护效力为100%,预防住院的保护效力为95%。在老年人(60岁及以上)中,预防重症保护效力为100%,预防住院的保护效力为100%。在用于异源加强免疫时,SCB-2019诱导的针对原型毒株和奥密克戎变异株的中和抗体水平比接种三剂阿斯利康疫苗的个体高出约4倍和约3倍。
4.誉衡药业LAG3单抗获批临床。誉衡药业重组全人抗LAG-3单克隆抗体注射液获批临床,拟开发用于治疗晚期恶性肿瘤。临床前研究数据显示,抑制LAG3能够让T细胞重新获得细胞毒性,从而增强对肿瘤的杀伤效果。目前,国内已有9款靶向LAG3的药物进入临床阶段,除亿佰康医药EOC202(eftilagimod alpha)是一款全新可溶性重组LAG3融合蛋白外,其余均是LAG3单抗。
5.天泽云泰AAV基因疗法获批临床。上海天泽云泰自主研发的AAV基因治疗产品VGB-R04注射液获CDE临床许可(CXSL2200055),适应症为先天性凝血因子IX缺乏引起的血友病B。VGB-R04静脉注射后,通过AAV衣壳蛋白介导的肝脏细胞转导,将VGB-R04表达盒递送至细胞核。VGB-R04表达盒以游离DNA的形式存在,在肝脏细胞中表达凝血因子Ⅸ高活性天然变体(hFIX Padua)蛋白。
6.药明CD19-CAR-T获批儿童临床。药明巨诺CD19-CAR-T产品倍诺达®(瑞基奥仑赛注射液)新适应症获批临床,拟开展一项I期临床,评估用于治疗儿童及年轻成人复发或难治性B细胞急性淋巴细胞白血病(r/r B-ALL)患者的安全性、耐受性、药代动力学(PK),并确定II期推荐剂量(RP2D)。倍诺达®是国内首款自主研发CAR-T产品,已获批用于治疗经二线或以上系统性治疗的复发或难治性大B细胞淋巴瘤(r/r LBCL)成人患者。
7.亦诺微与罗氏开展联合用药临床。亦诺微三合一疱疹溶瘤病毒MVR-T3011 IV与罗氏MEK抑制剂Cobimetinib将在美国开展联合用药临床研究,以评估组合疗法的安全性和有效性。MVR-T3011基于对I型疱疹病毒的全新设计,同时携带表达的两个外源性免疫调节基因PD-1抗体和IL-12,可促进肿瘤微环境的免疫反应。该疗法目前已在中美两国进入II期临床,单药治疗已显示出良好的安全性和初步疗效结果。
国际药讯
1.GSK口服HIF-PHI疗法在美报产。葛兰素史克新型口服HIF-PHI疗法daprodustat(达普司他)的上市申请获FDA受理,用于治疗慢性肾病(CKD)贫血患者,PDUFA日期为2023年2月1日。在一项III期临床试验(ASCEND)中,5项试验均达到主要疗效终点;与促红细胞生成素(ESA)相比,daprodustat并未增加心血管风险。2020年6月,该产品已在日本上市,由协和发酵麒麟负责分销。据悉,FDA此前已因安全性问题拒绝两款同类药品的上市申请。
2.再生医学公司Satellite Bio获1.1亿美元融资。Satellite Bio公司宣布完成总计1.1亿美元的种子轮和A轮融资。该公司的专有技术平台可以将不同类型的内分泌和旁分泌细胞(包括原代细胞,诱导多能干细胞分化的细胞,或者工程化细胞)植入到基质中,生成可以被移植到患者体内的移植体。通过手术移植到患者体内后,它们具有修补、恢复或者替代功能失常的组织或器官的潜力。
3.强生发布2022年Q1业绩报告。4月19日,强生公布2022年第一季度财务报表,总收入234.26亿美元,同比增长5%。其中制药业务收入128.69亿美元,同比增长6.3%。制药业务销售额排前五的产品包括乌司奴单抗(22.88亿美元,+6.5%)、达雷妥尤单抗(18.56亿美元,+36%)、依布替尼(10.38亿美元,-7.7%)、帕利哌酮缓释(10.48亿美元,+8.6%)和英夫利昔单抗(6.63亿美元,-14.7%)。
4.艾伯维与BioArctic终止PK疗法合作。BioArctic公司宣布终止与艾伯维于2016年签订的关于在帕金森病和其他运动障碍方面展开的α-突触核蛋白抗体ABBV-0805的合作协议。2019年,两家公司开始ABBV-0805的I期试验,并在2021年的国际会议上公布积极试验结果。临床前数据显示,该药物能够选择性地靶向定位可溶性有毒α-突触核蛋白聚集体。目前,双方终止合作的具体细节尚未对外披露。
医药热点
1.首个新冠病毒核酸检测国际标准发布。4月19日,国际标准化组织(ISO)发布《体外诊断检验系统—核酸扩增法检测严重急性呼吸系统综合征冠状病毒 2(SARS-CoV-2)的要求及建议》(ISO/TS 5798:2022)国际标准,围绕病毒诊断和筛查的核酸扩增法,对病毒检测方法的设计、开发、验证、确认和实施提出技术要求。这也是ISO发布的首个专门针对新冠病毒检测的国际标准,由中国市场监管总局组织中国华大基因、中国标准化研究院等单位提出并联合全球专家共同研制。
2.上海新增本土死亡病例8例。4月21日,上海市召开新冠疫情防控新闻发布会,介绍疫情防控最新情况。4月20日,上海新增本土死亡病例8例,平均年龄77.5岁。8位患者合并有晚期恶性肿瘤、严重心血管疾病、神经系统疾病、尿毒症等。其中2例曾接种过新冠肺炎病毒疫苗。截至4月20日24时,上海在定点医疗机构接受治疗的重型患者139例,危重型患者20例。
3.邹建军出任君实全球研发总裁。君实生物宣布,提名邹建军博士为公司执行董事,聘任其为公司副总经理并担任全球研发总裁,全面负责公司全球的研究与开发工作。邹建军博士在肿瘤临床治疗、抗肿瘤药物研发和新药临床研究等领域拥有近30年的丰富经验。在加入君实生物之前,她曾担任恒瑞医药首席医学官、副总经理。
4.个人养老金每年缴纳上限为12000元。4月21日,《国务院办公厅关于推动个人养老金发展的意见》发布,个人养老金实行个人账户制度,缴费完全由参加人个人承担,实行完全积累。《意见》明确,个人养老金参加人每年缴纳个人养老金的上限为12000元。人力资源社会保障部、财政部根据经济社会发展水平和多层次、多支柱养老保险体系发展情况等因素适时调整缴费上限。
评审动态
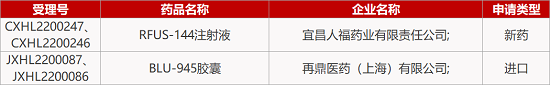
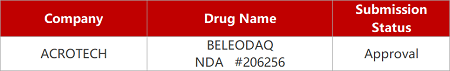

来源:药研发