您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2021-12-04 10:37
IS0 10993《医疗器械生物学评价》系列标准,旨在为医疗器械开发过程中的风险管理和整体性生物学评价提供准则和指南,从而保护使用者免受潜在的生物风险和危害。IS0 10993-1作为第一部分重要的纲领性文件,为生物安全评估提供了一般原则,也为结构化评估方案提供了一个框架。
本文试图通过IS0 10993-1最新版本解读,为大家更好理解和正确使用这个标准提供帮助。
一、本版的主要内容变化阐述:
修订附录A“生物风险评估中要解决的终点”,新增了“物理化学信息、材料热原、慢性毒性、致癌性、生殖和发育毒性和降解”的选项栏,矩阵中“物理化学信息”用“X”标识,为必做项目;其他项目用“E”标识,作为需要考虑的评价终点;
附录B“风险管理过程指南”用 “基于风险管理过程的生物学评价指南”取代(原ISO TR 15499);
增加ISO 10993系列标准中通用的名词术语;
增加“非接触医疗器械”和“短暂接触医疗器械”评价信息;
增加纳米材料和可吸收材料评价信息;
增加参考文献ISO 18562(全系列标准)“医疗应用中呼吸气路生物相容性评价”;
二、术语和定义变化
该部分变化很大,将原有的5个术语和定义进行了更新,并新增21个,新增术语和定义主要内容为:
►依据ISO 14971和ISO TR 15499的要求增加生物风险和生物评价术语;
►定义了器械接触类型,其中“外部接入医疗器械”中明确:直接或间接接触体内组织/体液,部分或整体位于体外的医疗器械或组件,均为外部接入器械,例如导尿管等。
►首次引入“非接触”和“短暂接触”的术语定义,并在5.3.2章节对短暂接触医疗器械作了具体的描述,列举了柳叶刀,皮下注射针,毛细管等接触时间小于一分钟的器械;
三、生物学评价基本原则变化
更新了4.1 中的生物学评价系统方法流程图,将“获得材料识别信息,要考虑化学表征”改为“获得物理/化学信息,考虑材料表征”;删除“化学成分是否相同”,增加物理表征“几何和物理性质是否相同”(见图1)。此修订意味着,产品的物理/化学特性已成为生物学评价的基本内容。同时,新版标准强调:如果材料表征证明目标产品与已评价过确认安全的医疗器械和材料等同(具体参照ISO 10993-18和ISO 10993-19),且有足够的信息对材料/医疗器械进行风险评估时,通常没有必要进行测试。
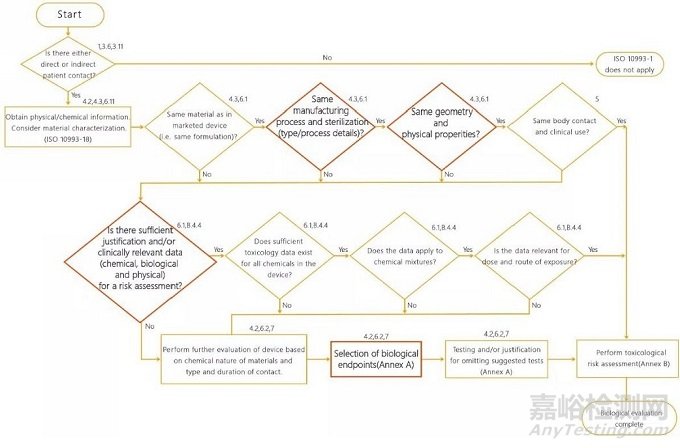
Figure 1-Summary of the systematic approach to a biological evaluation of medical device as part of a risk management process
4.3章节新增加了对于包装材料的考虑因素。直接或间接接触医疗设备的包装材料可以将化学物质转移到医疗器械上,然后间接地影响病人或医生,例如包装上的标签和油墨等。根据新版标准要求,需要考虑包装材料在货架期内,是否会影响医疗器械的安全性。对于纳米材料医疗器械,例如含有纳米涂层的介入类器械,由于具有潜在的独特特性,因此需要按照ISO/TR 10993-22:2017《纳米材料指南》进行研究和生物学评价。新标准明确强调:医疗器械风险评估应同时考虑局部和系统的影响。
4.7章节为新增条款----生产商对医疗器械的生物安全评价应覆盖医疗器械全生命周期。此规定引入了全生命周期的生物学评价,即除了研发阶段和临床前的生物学评价,临床试验直至产品退市阶段产生的所有数据,都将成为生物学评价报告更新的必要输入。
4.8章节为新增条款----对于可重复使用医疗器械,应对制造商确认过的最大使用次数进行生物安全评价,这也是风险分析和管理的正确应用。
4.11章节为新增条款,对该标准中的基本原则进行了标准符合性说明:
►已经按照老版本生物评价结束的医疗器械,该标准不强制重新测试;
►按照新版标准,任何生物相容性检验项目的豁免都需要提供合理解释,证明符合新标准要求;
►以往的临床安全资料,可作为在售医疗器械额外试验豁免的依据;
►任何医疗器械涉及4.9条款中描述的变更发生,必须按照新版标准进行生物风险再评价。
四、医疗器械分类变化
在5.1章节添加了2项举例说明:对于一个包括植入物和仅在手术过程中使用的输送系统两部分的医疗器械,考虑人体接触时间不同,植入物应该与输送系统分开评估。另外明确了间接接触的气路类医疗器械,其生物学评价的类型参照ISO 18562系列标准进行。
在5.2.1章节新增了非接触类医疗器械,明确非接触类医疗器械不需要进行生物相容性检验,比如医学诊断软件、体外诊断设备以及采血管等。
在5.2.2章节新增了备注解释,明确采用常规消费品原材料并与完整皮肤接触器械,无需更多的生物学评价。例如人机接触的电子设备(键盘、按钮、触摸屏、SD 卡、U 盘等)和与任何完整的皮肤接触的电子监视器或程序板(如手机、平板电脑等电子设备)或者与保护手套接触的器械(如导管的手柄)等。
在5.2.3章节新增一类虽不与组织/骨接触,但用于向组织或骨输送液体的导管类器械,也划分为外部接入器械,如灌注导管等。
在5.2.4章节将“主要与血液接触的器械”范围更新为“主要与心血管系统中循环血液接触的器械”,使之更加科学准确。同时增加备注:虽然很多组织含有循环血液,但这个分类并不包含植入此类组织的器械,例如疝气修补植入物。
在5.3章节将“永久接触(permanent)”替换成“长期接触(long-term)”,使表述更加严谨。因为有些长期植入类器械,由于某些原因只能维持几年就需要重新更换,并不能算作永久植入,例如心脏起搏器或冠脉支架等。其次新增了短暂接触医疗器械的分类,即规定接触时间小于 1 分钟的器械。短暂接触医疗器械通常不需要进行生物相容性检验,也未列入附录 A,但此类器械若涉及累积使用,则需要另外评价。
五、生物学评价过程变化
新版6.1“材料表征”替换为“用于生物风险分析的物理化学信息”,“化学表征”修订成“物理/化学表征”,并且强调在生物学评价和材料表征之前,必须收集器械/组件的物理和化学信息。此类信息的获取是生物学评价的第一步,并为材料表征和数据组提供产品信息依据。除了前版要求“所有材料、化学物质和工艺的结合在预期应用中使用安全”外,增加了“物理性质没有改变”才有可能豁免,并且需要文档记录豁免理由,以便追溯。对于磨损可能产生微粒的器械/组件,必须按照ISO/TR 10993-22:2017《纳米材料指南》进行纳米微粒的研究。
新版6.2最重要的是附录A的修订,现解读如下:
►使用“生物风险评估中需要考虑的终点”题目取代旧版的“生物评价试验”,更强调优先根据现有的信息资料进行评估,而不是盲目进行试验。新版评估表中新增6个评估考察终点:物理/化学信息、材料性热原、慢性毒性、致癌性、生殖/发育毒性和可降解试验。
►新版评估表使用符号“ E”(Endpoint的首字母) 取代旧版的 “ X ”,以标识生物风险评估的试验终点;
►新版评估表使用“X”表示生物学风险评估需要的前置信息,如物理/化学信息;
►新版评估表新增10条备注,包含参考标准、符号说明、评估项目使用注意事项,使整个表格的使用更加科学、准确、有针对性。
►新版评估表第六列遗漏了“致敏试验”的题头,估计以后的勘误会做修正。
新版6.3条款或术语名称更合理规范。有关生物单项测试的修订解读如下:
►将旧版“急性全身毒性”中的“热原试验”单列为6.3.2.5“材料介导热原”条款, 作为生物学评价的一部分。含有生物材料的器械容易发生“材料介导热原”,故要进行重点评估,例如来源于动物心包的心脏瓣膜;
►6.3.2.9中“植入(Implantation)”改为“植入影响(Implantation effects)”,并且提出,如果可能和适用,可同时评价对血液相容性的影响。
►对6.3.2.10“基因毒性”进行了修订,评价试验除ISO 10993-3标准外,还可以同时参考ISO/TR 10993-33:2015基因毒性评估测试指南(ISO 10993-3补充版)。对于体外阳性试验结果,旧版建议进行体内试验,否则假定材料具有致突变性;新版则建议优先进行可提取物和浸出物研究,对未知杂质进行化学鉴定,探明基因毒性的物质基础。同时,通过材料的化学表征,减少了动物的使用。
►新版6.3.2.12“生殖和发育毒性”为附录 A 新增评估项目。对于一般医疗器械不用考察评估,但对于新材料、具有已知生殖或发育毒性的材料、具有相关目标人群(例如孕妇)的医疗器械需要考虑。
►“降解试验(Degradation)”代替“生物降解”,而且新增了适用范围,即任何医疗器械、部件或残留在组织内的材料,只要可能在人体中降解,都需要提供降解试验信息。另外删除了旧版中“植入体内超过30天的器械”就需要评价降解的情况,原因是有些植入器械虽然超过30天,但材料明确为非降解材料就不必做类似评价试验。

来源:ISO 10993-1 2018