您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-11-01 09:25
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
国内药讯
1.全球首个长效降糖复方在华获批。诺和诺德研发生产的德谷胰岛素利拉鲁肽注射液(商品名:诺和益)获NMPA批准上市,联合其他口服降糖药物用于2型糖尿病患者的血糖控制。德谷胰岛素利拉鲁肽是全球首个获批上市的基础胰岛素胰高糖素样肽-1受体激动剂(GLP-1RA)注射液,由德谷胰岛素和利拉鲁肽组成,可一天一次有效控制全天血糖。它能够显著降低糖化血红蛋白(HbA1c),HbA1c<7%的患者比例达89.9%。
2.齐鲁「奥拉帕利」仿制药报产。齐鲁制药奥拉帕利4类仿制药上市申请获CDE受理。这也是该产品的首个仿制药上市申请。奥拉帕利是FDA批准的首个口服PARP抑制剂,原研产品为阿斯利康的Lynparza,该产品目前已在国内获批上市,用于复发性上皮性卵巢癌、输卵管癌或原发性腹膜癌患者的维持治疗;BRCA突变晚期卵巢癌的一线维持治疗;BRCA突变晚期上皮性卵巢癌、输卵管癌或原发性腹膜癌的维持治疗等多个适应症。
3.恒瑞新型AR拮抗剂拟纳入优先审评。恒瑞新型AR拮抗剂SHR3680片的上市申请获CDE拟纳入优先审评,用于治疗高瘤负荷的转移性激素敏感性前列腺癌(mHSPC)患者。在一项III期SHR-3680-III-HSPC研究中,与标准治疗联合雄激素剥夺疗法(ADT)相比,SHR3680联合ADT在这类患者中达到无影像学进展生存期(rPFS)的主要终点,显著降低患者的疾病进展或死亡风险。9月2日,SHR3680已获CDE突破性疗法认定。
4.百济神州HER2双抗启动Ⅲ期临床。百济神州HER2双抗Zanidatamab(研发代号:ZW25)登记启动一项国际多中心Ⅲ期临床。该项临床将在不可切除、局部晚期或转移性HER2阳性胃食管腺癌(GEA)患者中评估Zanidatamab联合化疗,联合或不联合替雷利珠单抗治疗的有效性和安全性。计划国内入组230人,国际入组1149人。主要研究者由北京肿瘤医院医学博士沈琳担任。
5.君实新冠中和抗体报IND。君实生物JS026注射液临床试验申请获CDE受理。JS026是一款重组单抗药物,以SARS-CoV-2刺突蛋白S1亚基为靶点,高亲和力结合受体结合区域(RBD),阻断RBD和宿主细胞表面受体血管紧张素转化酶2(ACE2)的结合,从而进一步阻断SARS-CoV-2侵染宿主细胞。君实生物旨在开发JS026与埃特司韦单抗(etesevimab,JS016)联合用于COVID-19各种病毒突变的预防和治疗。
6.药明康德第三季度财报公布。药明康德发布2021年第三季度业绩报告,第三季度实现营业收入59.85亿元,同比增长30.6%;归母净利润8.87亿元,同比增长36.2%。前三季度营收165.21亿元,同比增长39.8%;归母净利润35.62亿元,同比增长50.4%。第三季度各业务板块收入:化学业务36.51亿元(+33.3%);测试业务12.27亿元(+37.4%);生物学业务5.04亿元(+22.4%);细胞及基因疗法CTDMO业务2.83亿元(+14.7%);国内新药研发服务部3.11亿元(+10.5%)。
国际药讯
1.毛果芸香碱获批用于治疗老花眼。FDA批准艾伯维旗下艾尔建公司创新眼科配方Vuity(毛果芸香碱1.25%眼科溶液)上市,用于治疗老花眼。这也是FDA批准的首款用于治疗老花眼的眼药水疗法。在一项Ⅲ期临床中,与安慰剂相比,Vuity治疗组患者第30天检验近视力的指标获得显著改善,而且这一眼药水不会影响患者的远视力。它最快在滴入15分钟后生效,疗效可持续6个小时。
2.诺华白血病疗法获FDA批准上市。FDA加速批准诺华(Novartis)创新ABL1变构抑制剂Scemblix(asciminib)上市,用于治疗既往接受过两种以上TKI疗法治疗的Ph+慢性期慢性髓性白血病患者。FDA同时还完全批准Scemblix用于治疗携带T315I突变的上述患者。asciminib通过与ABL1的肉豆蔻酰口袋(myristoyl pocket)结合,抑制BCR-ABL1的活性。由于它与BCR-ABL1结合的位点与常见TKI不同,有望解决CML患者后期治疗中对TKI耐药和不耐受问题。
3.勃林格殷格翰IL-36R单抗报产。勃林格殷格翰IL-36R抑制剂spesolimab的上市许可申请(MAA)获欧洲药品管理局(EMA)受理,用于治疗泛发性脓疱性银屑病(GPP)的发作。在一项Ⅰ期临床中,与安慰剂组相比,spesolimab治疗组患者皮肤症状达到脓疱清除或几乎清除的患者比例更高。值得一提的是,这款免疫新药刚刚在中国完成上市申请的提交。
4.皮下注射RNAi疗法Ⅲ期临床积极。Alnylam公司RNAi疗法vutrisiran治疗遗传性转甲状腺素蛋白淀粉样变性多发性神经病(hATTR-PN)的Ⅲ期临床(HELIOS-A)获最新积极结果。该研究在9个月时间点已达到主要终点和全部次要终点。新的数据显示,与Onpattro对照组相比,vutrisiran治疗组18个月时患者的血清TTR水平降低方面达到非劣效性标准,显著改善神经病变损害、生活质量和步态速度等全部次要终点指标。详细结果将于2022年初的医学大会上公布。
5.光免疫疗法治疗头颈癌成果发表。日本乐天医药光免疫疗法RM-1929治疗局部区域性复发性头颈部鳞状细胞癌的Ⅰ/Ⅱa期开放标签(RM-1929-101,NCT02422979)研究成果发表在《Head and Neck》上。RM-1929的总体缓解率达到43.3%(95%CI:25.46%–62.57%),疾病控制率为80%(95%CI:61.43%–92.29%),患者的中位总生存期(OS)为9.30个月(95%CI:5.16–16.92个月)。Akalux(ASP-1929)是全球首次获批用于治疗头颈癌肿瘤光免疫治疗药物。
6.WHO启动新冠疫苗团结试验。世卫生织(WHO)宣布正式启动新冠疫苗团结试验(STV),以加速评估下一代新冠疫苗,并建立能够保护全世界人民的新冠疫苗组合。根据WHO最新公布的全球新冠疫苗名单,已入选新冠疫苗团结试验的两款疫苗分别为Inovio和艾棣维欣(苏州)联合开发的脱氧核糖核酸疫苗pGX9501/INO-4800,以及Medigen和Dynavax联合开发的重组蛋白疫苗MVC-COV1901。
医药热点
1.FDA/NIH领衔成立BGCT研发联盟。FDA联合美国国立卫生研究院(NIH),10家生物医药公司和5个非盈利组织成立BGCT(Bespoke Gene Therapy Consortium)组织,共同加快用于治疗罕见病的基因疗法的开发。BGTC将在AAV载体生产,载体递送转基因进入人类细胞,以及转基因在靶细胞中激活相关的生物学机制方面深入研发;并赞助4-6个基于AAV载体基因疗法的临床试验。NIH和私营合作伙伴将提供约7600万美元的支助。
2.去年全国230万人死于脑卒中。10月29日是第16个“世界卒中日”。10月28日,国家卫健委脑卒中防治工程委员会在上海市召开新闻发布会,介绍了我国脑卒中流行病学现状。数据显示,2020年我国40岁以上人群中有1780万名脑卒中患者,当年新发脑卒中患者达340万名,230万人因脑卒中死亡。在全国三级医院卒中中心,脑卒中患者到院至开始静脉溶栓时间中位数平均值为43分钟,已达到发达国家水平。
3.四川活动超百人需做核酸。四川省印发《关于从严从紧抓好全省文化和旅游系统疫情防控工作的通知》,督促旅游景区、公共文化场馆等文旅场所严格落实限量、预约、错峰要求,严格执行跨省旅游经营活动“熔断”机制、暂停经营旅游专列业务等。《通知》还明确要求减少各类聚集性活动,活动规模超过100人的,还需要出示48小时内的核酸检测报告。
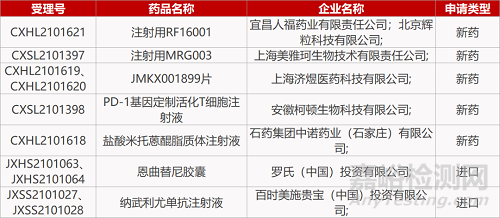
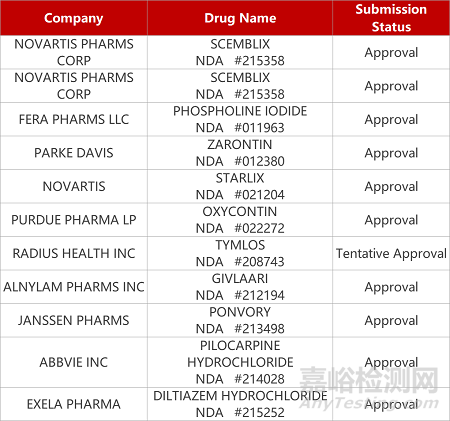
评审动态

来源:药研发


