您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-10-14 11:06
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
恩沃利单抗治疗乙肝IIa期临床积极。歌礼制药将在2021年美国肝病研究协会年会上公布皮下注射给药的PD-L1恩沃利单抗(ASC22)用于治疗慢性乙肝的IIa期临床研究成果。ASC22(0.3mg、1.0mg、2.5mg)单次给药12周后,患者乙肝表面抗原(HBsAg)呈现剂量依赖性下降趋势,其中2.5mg ASC22剂量组患者HBsAg最高降幅达1.2 log10 IU/mL;ASC22显示出良好的安全性及耐受性,研究期间的不良反应均为1级。
国内药讯
1.金赛药业重组人生长激素拟纳入优先审评。金赛药业重组人生长激素注射液的上市申请获CDE拟纳入优先审评,拟开发用于治疗儿童生长缓慢、儿童身材矮小等多种适应症。生长激素(GH)是由人体脑垂体前叶分泌的一种肽类激素,能促进骨骼、内脏和全身生长。该公司开发的重组人生长激素注射液已在中国获批8项适应症,包括今年9月底刚获批的性腺发育不全(特纳综合征)所致女孩生长障碍。
2.恒瑞「环磷酰胺胶囊」拟纳入优先审评。恒瑞医药环磷酰胺胶囊以“符合儿童生理特征的儿童用药品新品种、剂型和规格”拟纳入优先审评,拟定适应症包括恶性淋巴瘤、白血病、乳腺癌等多个瘤种。注射用环磷酰胺由Baxter Oncology GmbH公司开发。目前国内获批上市的环磷酰胺大多为注射用剂型和片剂,尚未有胶囊剂型获批上市。9月30日,恒瑞注射用环磷酰胺首家通过了仿制药一致性评价。
3.复宏汉霖LAG-3单抗国内启动临床。复宏汉霖重组抗LAG-3单抗注射液HLX26在中国境内开展的Ⅰ期临床首例受试者给药。该项开放标签、剂量递增试验将评估HLX26在晚期/转移性实体瘤或淋巴瘤患者中的安全性、耐受性和药代动力学特征。主要终点为首次给药后三周内的剂量限制毒性 (DLT) 和最大耐受剂量 (MTD)。次要终点包含不良事件、药代动力学参数、免疫原性及初步疗效评估。
4.百利药业EGFR/HER3双抗获批两项临床。百利药业1类新药SI-B001双抗注射液获CDE批准开展两项新的临床研究,拟联合FOLFOX/FOLFIRI或伊立替康或氟尿嘧啶治疗不可切除/转移性RAS野生型BRAF野生型MSS/pMMR结直肠癌;以及联合甲磺酸奥希替尼片治疗有EGFR突变的对第三代EGFR TKI不敏感或对第三代EGFR TKI敏感但治疗后耐药或进展的局部晚期或转移性非小细胞肺癌(NSCLC)。
5.烨辉医药引进CD74-ADC。烨辉医药宣布与Sutro Biopharma就Sutro拟用于治疗血液癌症的CD74-ADC药物STRO-001签署授权协议,烨辉将获得STRO-001在大中华区(包括中国大陆、香港、澳门和台湾)开发和商业化权益。根据协议,Sutro将获400万美元的首付款,可能高达2亿美元得潜在里程碑付款以及产品的销售提成。在美国,STRO-001正在多项临床中评估用于治疗多发性骨髓瘤、非霍奇金淋巴瘤和白血病的潜力。
国际药讯
1.新冠疫苗有效降低重症和病亡风险。法国医保局和药监部门组成的科研团队“疫情灯塔”(Epi-Phare)发布最新研究结果。研究人员通过复杂的数学分析比对去年12月27日至今年7月20日期间,法国1100万名50岁以上新冠疫苗接种者和1100万名50岁以上未接种疫苗人员的数据。结果显示,从注射第二剂疫苗(包括辉瑞、莫德纳、牛津/阿斯利康疫苗)的14天开始,疫苗可将住院和病亡的风险降低90%,而且这种效果在5个月的随访时间内并未降低。
2.多奈哌齐透皮制剂在美报NDA。FDA受理Corium公司多奈哌齐透皮贴片Adlarity的新药申请(NDA),用于治疗阿尔茨海默病(AD)所致的痴呆症患者,PDUFA日期为2022年3月11日。多奈哌齐是一款胆碱酯酶抑制剂,在美国已获批用于每日口服一片,治疗轻/中/重度AD患者。经Corium改良后的Adlarity透皮贴剂可连续贴敷7天,并具有一致的粘附性,提高患者依从性。
3.双环肽创新疗法Ⅱ期临床积极。Oxurion公司与Bicycle Therapeutics联合开发的基于双环多肽的血浆激肽释放酶(PKal)抑制剂THR-149,在治疗糖尿病黄斑水肿(DME)的Ⅱ期临床中获积极结果。THR-149(0.13 mg)治疗组第3个月时患者的BCVA(最佳矫正视力)提高了6.1个字母;HR-149的所有剂量水平均具有良好的安全性特征,所有不良事件的严重程度均为轻度至中度,未观察到炎症。
4.基因编辑CAR-T疗法早期临床积极。CRISPR Therapeutics公司基于CRISPR基因编辑的同种异体CAR-T疗法CTX110,在治疗CD19阳性大B细胞淋巴瘤的Ⅰ期临床中获积极结果。CTX110(剂量超过10^8个细胞)单剂治疗达到58%的总缓解率和38%的完全缓解率。CTX110表现出差异化的积极安全性特征。没有出现移植物抗宿主病,所有的细胞因子释放综合征(CRS)均为1级或2级。
5.1型糖尿病突破性疗法机制研究结果积极。vTv Therapeutics创新葡萄糖激酶激动剂TTP399在机制研究中获得积极结果。正在使用胰岛素泵的1型糖尿病患者接受TP399或安慰剂治疗,患者7天后停止使用胰岛素泵。结果显示,TTP399治疗组患者在退出胰岛素治疗期间相比安慰剂组没有发生酮酸水平增高;TTP399能够改善空腹血糖控制,而且该组没有发生低血糖事件。FDA此前已授予TTP399治疗1型糖尿病的突破性疗法资格。
6.Jadeite与Nasdaq达成儿科罕见肝病新药合作。Jadeite公司宣布与Albireo公司签订独家许可协议,在日本开发和商业化非系统性回肠胆汁酸转运抑制剂odevixibat(Bylvay),用于治疗进行性家族性肝内胆汁淤积症 (PFIC)、Alagille综合征和胆道闭锁。Bylvay是首个在欧美获批用于治疗所有类型PFIC的药物。PFIC是一种罕见的儿童疾病,导致进行性、危及生命的肝病。根据该协议,Albireo将获得1500万美元的预付款,高达1.2亿美元的里程碑付款以及产品的销售分成。
7.罗氏引进耐药性癫痫基因疗法CG01。罗氏旗下Spark Therapeutics与CombiGene就后者的AAV基因疗法CG01签署合作许可协议,获得CG01在全球的开发、制造和商业化权益。CG01是一款旨在治疗耐药性局灶性癫痫的基因疗法,已在临床前研究中取得积极结果。根据协议,CombiGene将获得850万美元的预付款,5000万美元的里程碑后付款以及产品的销售分成。
8.武田拟合作开发非病毒基因疗法。Poseida公司与武田达成一项研发合作和授权协议,将利用Poseida的piggyBac、Cas-CLOVER、和生物降解性纳米颗粒技术,共同开发多款非病毒体内基因疗法,其中包括Poseida治疗血友病A的候选基因疗法。根据协议,Poseida将获得4500万美元的预付款和可超过1.25亿美元的临床前里程碑付款。如果武田选择添加两个额外研发项目(总计8个研发项目),Poseida有可能总计获得高达36亿美元的里程碑付款。
医药热点
1.北京可线上变更医保定点医疗机构。为方便群众变更城镇职工基本医疗保险定点医疗机构,北京医保局日前正式上线试运行城镇职工基本医疗保险定点医疗机构自主变更业务。该业务在“医保北京”公众号、“北京市社会保险网上服务平台”均可办理。网上自主变更定点医疗机构的时间为每月4日至月末最后一天;变更成功后,当日页面不显示,次日生效。
2.陈宝剑任北京大学医学部党委书记。北京大学医学部日前在逸夫楼报告厅召开中层干部会议,北京大学党委组织部部长宣布关于医学部党委书记的任免通知。学校研究决定,任命陈宝剑为北京大学医学部党委委员、书记(兼),刘玉村不再担任北京大学医学部党委书记职务。公开资料显示,陈宝剑,男,汉族,1979年5月出生于江苏徐州,中共党员,研究生学历,法学博士。
评审动态
申请临床:
越洋医药的维格列汀缓释片。
申请生产:

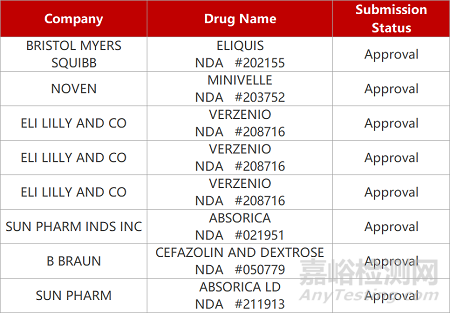

来源:药研发


