您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-07-22 21:30
一、中央监护软件的结构与工作原理
1.中央监护软件的结构
产品组成应明确中央监护软件的物理组成和逻辑组成,其中物理组成如光盘、U盘或预装于计算机等;逻辑组成应描述临床功能模块,包括服务器(如适用)和客户端,如适用应注明选装和模块版本。
2.中央监护软件的工作原理
2.1.逻辑结构
逻辑结构应描述产品的体系结构,可以按照功能模块或组成模块进行描述,也可采用其他方式进行描述,给出示意图并依据示意图进行描述。
如,结构示意图及相应描述示例可如下(图1):
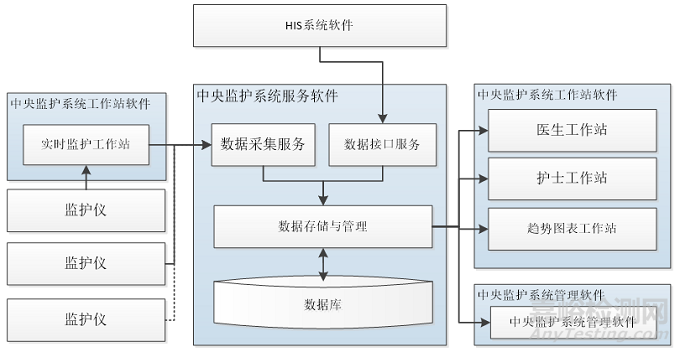
图1. 结构示意图
2.2. 物理结构
物理结构应描述产品的物理拓扑和技术规格,物理拓扑可以结合产品架构或产品规模进行描述,也可采用其他方式进行描述,出具示意图并依据示意图进行描述。
技术规格应描述产品运行所需的技术要求和硬件要求,如通信标准或协议(如HL7)、存储模式[如三级存储模式(在线、近线和离线)或两级存储模式(在线和备份)]、存储格式、网络类型(如局域网、广域网、无线网、遥测网)、传输内容(如文字、图像、视频)、存储介质(如磁盘、光盘、移动存储器)、显示器(如分辨率、亮度)、辅助设备(如条码扫描设备、IC卡读写设备)等。
如,物理拓扑示意图及相应描述示例如下(图2):
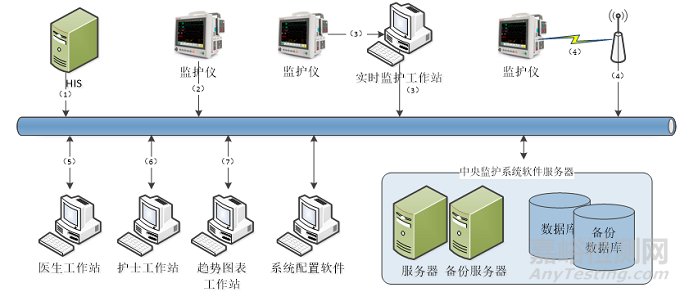
图2. 物理拓扑示意图
二、中央监护软件的研发实验要求
1.产品的研究要求
中央监护软件的软件安全性级别为C级;申请人应参照《医疗器械软件注册技术审查指导原则》(国家食品药品监督管理总局通告2015年第50号)关于独立软件的相关要求给出相应的软件描述文档。
2.主要性能指标
2.1 通用要求
2.1.1 处理对象
明确软件的处理对象类型、数据(如心电(ECG)、呼吸(RESP)、体温(TEMP)、脉搏血氧饱和度(SpO2)、脉搏率(PR)、无创血压(NIBP)、产科胎心率及宫缩压力、脑电图、有创血压等)。
2.1.2 最大并发数
明确软件的最大并发设备数。
2.1.3 数据接口
明确软件的通用数据接口(如Dicom、HL7)、产品接口(可联合使用的独立软件、医疗器械硬件)。
2.1.4 特定软硬件
明确软件完成预期用途所必备的独立软件、医疗器械硬件。
2.1.5 临床功能
依据说明书明确软件全部临床功能纲要(注明可选)。
2.1.6 使用限制
依据说明书明确软件的使用限制。
2.1.7 用户访问控制
明确软件的用户访问控制管理机制。
2.1.8 版权保护
明确软件的版权保护技术。
2.1.9 用户界面
明确软件的用户界面类型。
2.1.10 消息
明确软件的消息类型。
2.1.11 可靠性
明确软件出错后数据保存与恢复能力。明确数据传输后数据的一致性和完整性。
2.1.12 维护性
明确软件向用户出具的维护信息类型。
2.1.13 效率
明确软件在典型配置条件下完成典型临床功能所需的时间,如:明确在指定测试条件下传输数据的时间,测试条件应明确网络环境以及硬件配置。
2.1.14 运行环境
明确软件运行所需的硬件配置、软件环境和网络条件,包括服务器(如适用)和客户端的要求。
2.2 质量要求
符合GB/T 25000.51中相关要求。
2.3 专用要求 (如适用)
如果中央监护软件能够判断、形成报警信息并执行报警(而不是仅从床旁监护仪获得报警信号),应符合YY 0668—2008的51条款(危险输出的防止)。
如果中央监护软件能够显示心电波形,应符合YY 1079—2008的4.2.8条款(对具有心电图波形显示能力的监护仪的特殊要求)。
2.4 安全要求
符合YY 0709的要求。
三、相关标准
表1. 相关标准
|
标准编号 |
标准名称 |
|
GB/T 25000.51—2010 |
软件工程 软件产品质量要求与评价(SQuaRE)商业现货(COTS)软件产品的质量要求和测试细则 |
|
YY 0668—2008 |
医用电气设备 第2—49部分:多参数患者监护设备安全专用要求 (51条款:危险输出的防止) |
|
YY 0709—2009 |
医用电气设备第 1—8 部分:安全通用要求并列标准:通用要求,医用电气设备和医用电气系统中报警系统的测试和指南 |
|
YY 1079—2008 |
心电监护仪(4.2.8条款:对具有心电图波形显示能力的监护仪的特殊要求) |
|
YY/T 0316—2016 |
医疗器械 风险管理对医疗器械的应用 |
|
YY/T 1437—2016 |
医疗器械YY/T 0316应用指南 |
|
ISO/HL7 21731—2014 |
医疗信息交换标准HL7 |
四、主要风险
中央监护软件的风险管理报告应符合YY/T 0316—2016《医疗器械 风险管理对医疗器械的应用》及YY/T 1437—2016《医疗器械YY/T 0316应用指南》的有关要求。
表2. 产品主要危害
|
可能产生的危害 |
形成因素 |
|
A.能量危害 |
|
|
电能—网电源 |
意外断电,将影响处理中数据的可靠性、稳定性。 设备停电后又恢复时可造成图像数据失真、丢失等危害。 |
|
电磁能 |
计算机和网络设备电磁兼容环境差影响软件正常使用。 |
|
B.操作危害 |
|
|
功能 |
中央监护软件在存储和传输过程中,可能出现患者信息的隐私泄露、数据丢失、无法访问、感染软件病毒等危害。 |
|
不正确或不适当的输出或功能 |
中央监护软件在存储和传输过程中,患者信息和医学信息资料可能出现不匹配、不准确,造成延误诊断、诊断错误等。 |
|
中央监护软件在存储和传输过程中,可能出现信息无法存储、无法传输、模糊等质量问题及不能恢复到原始数据,造成延误诊断或造成诊断错误。 |
|
|
中央监护软件人机交流界面应清晰明确、易操作,功能设置应明确、易识别,不能过于复杂,否则容易出现错误造成危害。 |
|
|
错误的数据转换 |
数据存储或传输中出现数据错误。 |
|
功能的丧失或 变坏 |
软件在单一故障状态(如信息存储故障、信息传输延迟等)硬件单一故障状态(如:CPU故障死机,内存故障,声卡故障,磁盘故障,显示故障,网络故障等)下运行可产生危险。 |
|
使用错误造成的危害、缺乏注意力、不遵守规则、缺乏常识、 违反常规 |
未按操作手册或说明书进行安装、调试、使用,对软件正常使用造成隐患。 由不熟练/未经培训的人员使用易造成危害,操作人员必须经过严格培训,否则可能产生各种危害。 |
|
C. 信息危害 |
|
|
标记 |
软件包装标记不全面、标记不足、标记不正确或不能够清楚易认。如:软件版本、软件名称等标记出现问题,易产生安装、调试错误。 |
|
使用说明书、操作说明书 |
没有使用说明书和技术说明书,或其内容不全、有缺失。如缺少必要的警告说明、缺少详细的使用方法、缺少必要的技术参数、缺少安装调试说明、缺少运输和贮存环境条件的限制。 性能特征的不适当的描述。 不适当的预期使用规范。 过于复杂的操作说明。 |
|
与消耗品/附件/其他医疗器械的不相容性 |
同中央监护软件一起使用的硬件装置、网络情况与中央监护软件不相适应,将对中央监护软件使用产生危害,如存储空间不足,无法存储新的监护信息;如网络故障,无法进行信息传输,可能对患者造成延误医疗处置。 |
|
警告 |
警告不恰当、不充分。 |
|
服务和维护规范 |
服务和维护规范缺少或不适当,包括维护后功能性检查规范的不适当。 说明书中应提供维护、校正细则等可供技术人员维护的必需资料。 技术人员在维修后应对软件进行功能性检查,达到相关要求后再投入使用,否则将带来危害。 |

来源:嘉峪检测网


