您当前的位置:检测资讯 > 生产品管
嘉峪检测网 2021-07-09 12:47
滴眼剂系指由原料药物与适宜辅料制成的供滴入眼内的无菌液体制剂,系直接用于眼部发挥治疗作用的无菌制剂,其【无菌】项目检查,除另有规定外,照无菌检查法(通则 1101)检查,应符合规定[1]。正因为眼用制剂用药部位的特殊性,目前对其质量、安全性要求已逐渐向注射剂方向靠拢。自《中国药典》(2010 年版)和《药品生产质量管理规范》(2010 年修订,以下简称新版 GMP)实施以来,如何确保眼用制剂的无菌性以及多剂量眼用制剂采用无菌工艺生产的必要性等问题一直是眼用制剂生产企业最为关注的焦点[2]。《药品 GMP 指南》无菌药品分册中明确将滴眼剂的生产纳入按无菌药品管理的范畴,并强调采用无菌工艺来减少可能引起的微粒、微生物和内毒素的潜在污染[3],因此,滴眼剂生产洁净厂房的设计或升级改造如何体现并满足GMP(2010年版)和中国药典的要求,是影响滴眼剂产品关键质量属性及体现无菌生产工艺的基础,是确保滴眼剂产品质量安全、有效的关键。本文通过对实施新版 GMP 以来,我省近几年的滴眼剂生产洁净厂房的升级改造或初步设计存在的问题进行归纳汇总、统计分析,重点分析滴眼剂生产洁净厂房在实现无菌生产工艺存在的问题,并提出建议,期望为滴眼剂生产企业厂房升级改造或初步设计提供指导。
1 常见问题概况
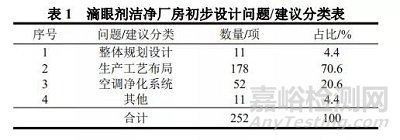
我省近几年滴眼剂洁净厂房系统初步设计共发现 252 项问题或建议,在风险分析基础上结合 GMP(2010 年版)要求进行分类:(1)生产车间整体规划设计,如共用设施设备、激素类与非激素类产品共线生产等;(2)生产工艺布局,如功能间规划、内包材转运等;(3)空调净化系统,压差设置不合理,换气次数核算不合理等;(4)其他问题,如 B 级区废弃物传出通道、消毒液过滤室的位置设计等。详见表 1。
2 问题/建议分析
2.1 生产车间整体规划设计
根据分类及表 1 数据,滴眼剂洁净厂房生产车间的整体规划设计方面共提出 11 项建议,占比 4.4 %,如,部分初步设计的滴眼剂生产与其他的药品(如滴耳剂)的生产规划设计在同一生产车间,且共用部分设施设备。GMP 规范第四十六条规定:为降低污染和交叉污染的风险,厂房、生产设施和设备应当根据所生产药品的特性、工艺流程及相应洁净度级别要求合理设计、布局和使用[4]。建议采用风险管理工具,结合产品特性开展多品种共用的可行性评估,并制定和实施相应的风险控制措施,降低污染和交叉污染的风险。
部分初步设计激素类与非激素类滴眼剂产品生产线设置在同一生产车间,共用部分设施设备。GMP 规范第四十六条(四)规定:生产某些激素类、细胞毒性类、高活性化学药品应当使用专用设施(如独立的空气净化系统)和设备;特殊情况下,如采取特别防护措施并经过必要的验证,上述药品制剂则可通过阶段性生产方式共用同一生产设施和设备[4]。根据国家食品药品监督管理高级研修学院组织编写的《2010 年版 GMP 疑难问题解答》的解释,“特殊情况”是指没有条件单独设置且采取特别防护措施并经过必要的验证证明可以共用的情况,是否可以共用不仅是针对品种而且是针对验证结果来确定。建议在条件允许的情况下,激素类药品与非激素类产品分别设置生产操作车间,使用专用的设施(如独立的空气净化系统)和设备,防止交叉污染。
2.2 生产工艺布局方面
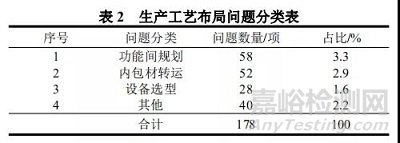
从表 1 可以看出,生产工艺布局的问题出现的频次最多,共178 项,占 70.6 %,对问题按影响产品关键质量属性、影响实现无菌生产工艺等因素分类:(1)功能间规划;(2)内包材转运;(3)设备选型;(4)其他。
2.2.1 功能间规划
GMP 规范第四十条要求:生产、行政、生活和辅助区的总体布局应当合理,不得互相妨碍;厂区和厂房内的人、物流走向应当合理[4]。部分设计 B 级洁净区的人员进出通道未分开设计。人流、物流设计或功能间规划不合理,容易造成混淆、差错及污染,建议在进行功能间平面布局时,应结合所生产的药品特性、生产工艺流程以及生产环境洁净度要求来进行设计,使上下游操作岗位连续、顺应流程要求,以利于生产操作,并能防止生产过程中的污染与交叉污染,保证对生产过程进行有效管理。同时,应使人物流路线尽量短些,避免迂回往返。人物流通道要分开设置以最大限度地避免混杂以及交叉污染[5]。
2.2.2 内包材转运
一般情况下,滴眼剂生产企业内包材来源有几种情况,一是外购无菌内包材,二是外购未灭菌内包材,三是自行生产无菌内包材(吹灌封一体生产工艺)。
部分拟采用外购已灭菌内包材的厂房设计无法保证已灭菌的内包材转运始终在 A 级层流保护下运送至灌装设备,传递过程存在污染风险,不便于生产操作和管理。建议已灭菌的内包材或外购的无菌内包材经物净后,采用逐层脱外包的方式传入 B 级洁净区,应能保证内包材的转运始终处在 A 级层流保护,并在灌装线的自净区自净后送至灌装设备。
2.2.3 生产设备选型
随着 2010 版《中国药典》规定滴眼剂其【无菌】项目检查,除另有规定外,照无菌检查法(通则 1101)检查,应符合规定[1]。越来越多的滴眼剂生产企业在厂房设计时考虑采用 BFS(吹灌封)三合一技术。
GMP 无菌药品附录第十七条要求:用于生产非最终灭菌产品的吹灌封设备自身应装有 A 级空气风淋装置,人员着装应当符合A/B 级洁净区的式样,该设备至少应当安装在 C 级洁净区环境中[7]。部分拟采用吹灌封三合一技术的厂房设计,未充分考虑并降低生产过程中开口容器和产品暴露的污染风险。建议吹灌封设备的制瓶、灌装和封口,应在 A 级送风保护下进行,并充分考虑制瓶和灌装之间药液短时间暴露带来的污染风险。
部分设计采用吹灌封三合一生产工艺,配制系统的设计未充分考虑各种组分的添加、溶解方式和除菌方式。由于滴眼剂配制系统比较复杂,滴眼剂基质组分物理性质差异大、种类多,配制系统可能需要配备多个不同功能的罐体和管路,还可能涉及均浆剂或均质机等设备,建议综合以上因素考虑,滴眼剂配制罐应具有升温、降温功能,配制系统能实现在线清洁 CIP 和在线灭菌SIP。
2.2.4 其他
在实现滴眼剂无菌生产工艺布局方面,设计较多存在未采取措施降低对核心灌装区域的污染风险。如在 B 级区设置气闸间实现物品传递,建议将气闸间改为带层流的传递窗或采取其它隔离措施降低对核心灌封工序的污染风险。
2.3 空调净化系统
滴眼剂生产环境如果得到妥善的设计、建造、调试、运转和维护,有助于确保滴眼剂产品的质量,提高产品的可靠性。良好的生产环境离不开空调净化系统,从表 1 可以看出,空调净化系统的问题共有 52 项,占 20.6 %,如压差设置不合理,洁净区换气次数核算不合理等。
2.3.1 压差设置不合理
GMP 规范第四十八条要求:洁净区与非洁净区之间、不同洁净级别洁净区之间压差应不低于 10 帕斯卡。必要时,相同洁净度级别的不同功能区域(操作间)之间也应当保持适当的压差梯度[4]。控制房间压差(气流方向控制)对大多数生产操作的保护起着关键作用[9]。部分设计功能间压差设置不合理,例如 C 级洁净区的配液室应设置为与相邻的 B 级洁净区维持相对负压,且压差应不低于 10 Pa;C 级洁净区内配料、乳化等功能间宜与 C 级洁净走廊维持相对负压,避免配料、乳化等易产尘功能间对 C 级洁净走廊造成污染。
2.3.2 洁净区换气次数核算不合理
换气次数(换气率)是指 1 小时内房间风量(体积流量)更换次数。国外制药工业对区域最低换气率的管理要求有共同的认识,对分级区而言,通常为每小时 20 次。ISPE 指南中经验法则的典型数值为:ISO8 级(EMEA C 级动态标准)空间,20~40 次/h;ISO7级(EMEA B 级动态标准)空间,40~60 次/h[9]。部分设计洁净区换气次数设置不合理,如 B 级洁净区的换气次数为 30 次/小时,C级洁净区的换气次数为 18 次/小时,换气次数偏低,建议考虑“空间产生的热湿量、空间产生的微粒数、维持环境级别所需的自净时间”三个准则中的最不利情况[9],重新核算各功能间的换气次数。
2.4 其他
其他问题共有 11 项,占比 4.4 %,较为重要的是 B 级区废弃物的传出通道及滴眼剂车间消毒液过滤室位置的问题等,如部分设计未设立 B 级区废弃物传递通道。为防止污染和交叉污染,建议根据生产需要,宜在 B 级区设置独立的废弃物传出通道。部分设计滴眼剂车间的消毒液过滤室距离 B 级区较远,建议靠近灌装室(B 级洁净区)设置,尽量缩短管道长度,降低污染风险,且除菌过滤后的消毒液经管道传入灌装室,并在 B 级洁净区增设消毒液专用接收区。
3 小结
滴眼剂车间的生产品种由于其产品特性及无菌生产工艺的特殊性,对洁净厂房初步设计提出了较高的要求。与普通产品的车间设计同样需考虑厂房的整体规划外,还应在全面考虑滴眼剂配制工艺的复杂性,除菌工艺的多样性基础上,重点考虑车间的无菌生产工艺布局,集中体现在生产车间的功能间规划、无菌内包材的转运及灌装设备的选型等,通过厂房设计中正确的流程设计、设备选型和平面布置来提高滴眼剂生产的无菌保证水平[6]。洁净区空调净化系统的设计应重点关注压差设置、换气次数等问题,设计还要考虑 B 级区废弃物传递、消毒液过滤室的位置等因素,最大限度避免交叉污染,设计出更优化的方案。
文章来源如下:


来源:广东化工


