您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-06-30 22:48
摘要
纳米晶体药物具有无需载体材料、易工业化和剂型多样化,且能显著提高难溶性药物的溶解度和生物利用度等优势,已经有多种药物上市。传统的纳米晶制备技术存在制备效率低和最小可实现粒径的工艺限制的问题。随着药物制剂制备技术的进步,纳米晶体药物的制备技术也在不断提升,不断涌现出新的制备技术。新技术的出现大大缩短了工艺时间,使制备更小粒径的纳米晶药物成为可能。本文从“Top-down”技术、“Bottom-up”技术及组合技术三个方面对纳米晶体药物的制备技术,尤其是高重力控制沉淀法、微射流反应技术和多种组合技术等新型制备技术进行了综述,并对新型制备技术的发展进行了展望,以期为纳米制剂相关研究提供借鉴。
关键词
纳米晶体;难溶性药物;制备技术;溶解度;生物利用度
正文
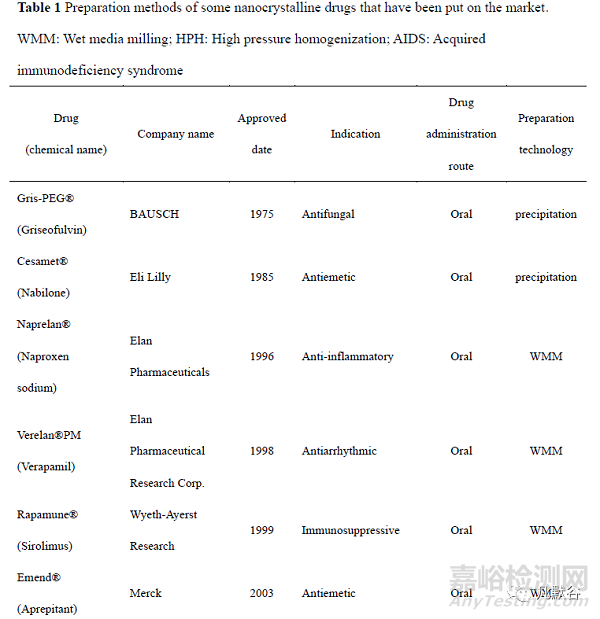
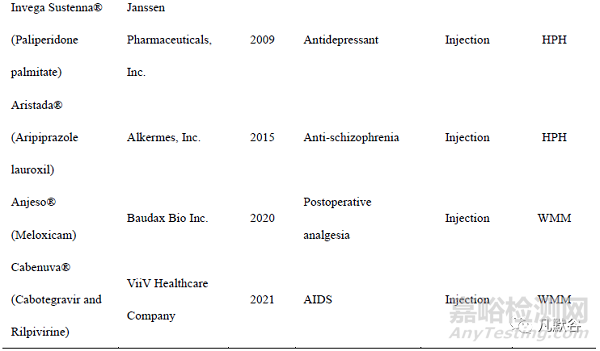
纳米晶体药物(nanocrystal drugs)是指将原料药直接纳米化,无需载体材料,粒径小于 1 μm 的药物颗粒。与原料药相比,纳米晶体药物的溶解度和溶出度增加,对生物膜的黏附性增大,食物对其干扰降低,其作为药物递送系统可进一步固化并加工成各种剂型,涵盖片剂、胶囊和冻干粉针剂等。目前已经有多种纳米晶药物上市(表 1)。其中,Merck 公司于 2003 年利用纳米晶体技术开发了纳米制剂阿瑞匹坦胶囊 Emend,与普通混悬液相比,其不仅提高了人体生物利用度, 而且消除了食物效应,Emend的服用不受空腹或进食的限制,具有巨大的临床意义。美国 Par Pharmaceuticals 开发的甲地孕酮口服纳米晶混悬液Megace®ES 与普通微米制剂相比,体内吸收速度显著增加,空腹给药的生物利用度提高了1.9 倍,而且其给药体积仅是微米制剂的 1/4,大大增加了患者的顺应性。于 2020 年上市的全球首个用于静脉注射的纳米混悬液 Anjeso®,较口服美洛昔康片剂 MOBIC®的达峰时间缩短了 50 多倍,药峰浓度增加了 4.6 倍,生物利用度提高了约 1 倍,并且其较高的载药量使其有效止痛时间长达 24 h,该药有望改变目前临床上针对急性疼痛的以阿片类药物为主导的治疗模式,具有重大的临床意义。迄今为止,纳米晶体药物主要有 3 种制备技术—“Top-down”(自上而下)技术、“Bottom-up”(自下而上)技术和组合技术。“Top-down”技术中,原料药通过一定的机械过程缩小药物颗粒尺寸至纳米范围,常用方法有湿法介质研磨法(wet media milling,WMM)和高压均质法(high pressure homogenization, HPH),大部分已上市的纳米晶药物采用这两种方法制备。“Bottom-up”技术是通过控制药物的结晶和成核过程得到粒径在纳米范围的药物晶体,常用方法是微量沉淀法。组合技术通过将预处理步骤和粒径减小步骤相结合来制备药物晶体,多个技术的协同使用在一定程度上能够改善药物的粒径减小效果,并减少能耗。本文从“Top-down”技术、“Bottom-up”技术以及组合技术三个方面系统介绍了纳米晶的新型制备技术。

1、“Top-down”技术
1.1 介质研磨法
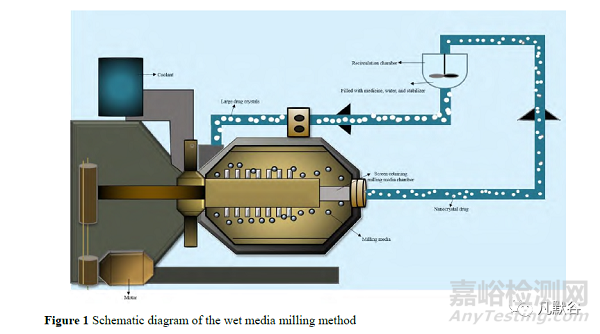
介质研磨法有干法研磨和湿法研磨两种。其中湿法研磨工业应用更广,其原理如图 1,将悬浮液加入装有研磨介质的容器中搅拌,在搅拌过程中,药物颗粒、研磨介质、装置的器壁三者相互碰撞产生高能剪切力,为药物颗粒的尺寸减小提供能量输入[1]。根据生产工艺的差异,此法又有通道式和循环式两种模式。通道模式中粗混悬液从进料罐进入,研磨形成的纳米混悬液输出到出料罐中,若要获得粒径均一的纳米晶,需要将出料罐中的混悬液倒入进料罐中或将进料罐和出料罐的位置互换,以进行反复研磨。而循环模式中,混悬液只需要利用一个容器进行循环研磨,这种再循环模式提高了产品的均匀度,使最终晶体的尺寸更小。此法具有操作简单、成本低,且制得的颗粒粒径分布较窄的优点[2],在实验室和工业上得到广泛应用。但是其最终制得的纳米晶药物中常包裹有残留的研磨介质,在一定程度上降低了产品的纯度。
1.2 高压均质法
根据使用的仪器和溶液的差异,高压均质法可分为不溶性药物输送微粒技术(insoluble drug delivery particles, IDD-P)、dissocubes技术和nanopure技术[3]。IDD-P技术使用射流均质器对悬浮液进行均质化,其中的药物通过碰撞而破碎[4]。Dissocubes技术使用活塞间隙均质器进行均质化,混悬液反复以高速通过均质器中狭窄的小间隙,此过程中仪器的压力逐渐升高,促进间隙中液体沸腾形成气泡,液体离开间隙时,气泡遇常压会破裂产生空化力,促进药物颗粒破碎[5]。Nanopure技术最突出的特点是可在非水介质中进行,因此适用于易水解药物的生产。同dissocubes法,药物在与非水介质混合后,所得的混悬液通过活塞间隙均质器进行均匀化制备。与上述的介质研磨法相比,高压均质法对环境更友好,没有研磨介质的污染,工业生产中得到广泛应用。
1.3 激光烧蚀和破碎技术
近年来激光烧蚀和破碎技术被越来越多地应用于纳米粒的制备。在激光烧蚀中,固体被照射后喷射出的物质在周围的液体中形成纳米颗粒。在激光破碎中,微粒的粗悬浮液被辐照后直接破碎成纳米颗粒。研究发现,飞秒激光照射比纳秒激光照射更能产生纳米级的粒子[6]。飞秒激光碎片是由物体内压增加产生的。飞秒激光产生的多光子被目标表面的分子吸收,超短脉冲时间内目标内的能量快速累积,在转化为热量之前,能量在激光焦点周围产生冲击波,促进药物颗粒破碎。而由于脉冲时间较长,纳秒激光的能量以热的形式积聚起来,加热后的化合物升华成单个分子,在水溶液中重新结晶,形成纳米沉淀物。和纳秒激光相比,飞秒激光烧蚀的目标不受热,药物的降解少。激光烧蚀和破碎的过程中,激光强度、激光的扫描速度、混悬液的性质等因素均对最终纳米颗粒的粒径有影响。激光烧蚀和破碎技术最显著的优点是操作过程中无有机溶剂的参与,但是此法可能引起小部分药物的氧化降解和晶型改变。此法已成功用于制备紫杉醇、醋酸甲地孕酮[7]和姜黄素[8]纳米混悬液。
2、“Bottom-up”技术
2.1 微量沉淀法
微量沉淀法是将药物溶液加入到能与溶剂混溶但不能溶解药物的反溶剂中使药物沉淀的过程。此法面临的主要问题是难以对纳米晶药物的尺寸进行精确控制。为了尽量减少纳米晶药物的聚集,操作中常常需要对稳定剂的种类和用量、药物浓度以及溶剂和反溶剂的比例等参数进行精确筛选和控制。此外,此法制得的纳米晶产物中常有有机溶剂残留。局限于生产过程控制的复杂性和残留有机溶剂的毒性等问题,目前此法只是在实验室进行小规模施行,工业化生产中应用得很少。
2.2 高重力控制沉淀法
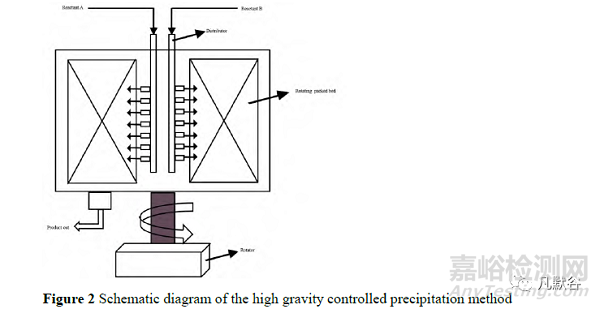
将“Bottom-up”技术中的沉淀法进行改进能够获得更加均匀的小粒径纳米晶药物。Chen 等[9]于 2000 年提出的高重力控制沉淀法(high gravity controlledprecipitation, HGCP)是一种较有前途的纳米晶制备技术,装置如图 2,两股流体沿管道流入旋转填料床,在转子的带动作用下,填料床以每分钟几百到几千次的速度旋转,两股流体在高速离心力的作用下进行混合、扩散,并形成小液滴从出口流出。转速、反应物浓度和体积流量是影响颗粒尺寸的关键因素。Chan 等[10]发现,随着填料床旋转频率的增加,纳米晶平均粒径迅速减小,直到在 20~25 Hz 的较高频率下达到 50 nm 以下的稳定粒径;超过 25 Hz后,转速进一步增加不会影响颗粒大小。而反应物浓度与体积流量增加会使溶液的过饱和度和成核速率升高,从而导致小颗粒的生成。HGCP 最大的优点是操作不需要稳定剂。但是在物料的混合过程中,进料流会在湍流边缘形成局部过饱和,导致连续成核和粒径分布扩大,此现象会随着产量的增加而加剧,这一特点使得高重力控制沉淀法的工业化应用受限[11]。此法在实验室规模中已成功用于制备硫酸沙丁胺醇、多柔比星、索拉菲尼和西罗莫司等纳米粒[12-15]。
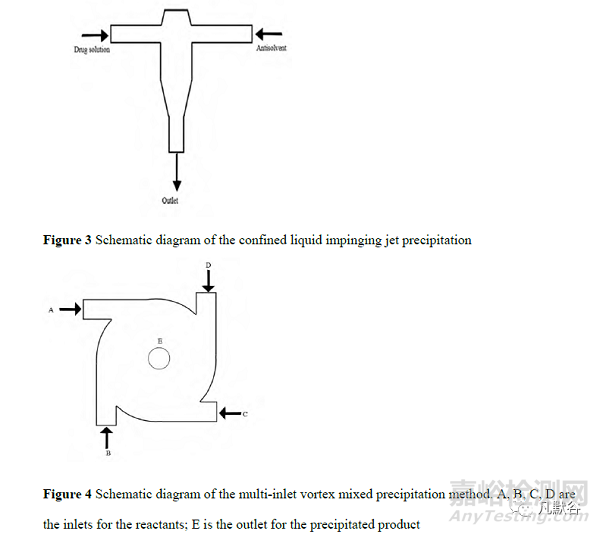
2.3 受限液体撞击射流沉淀和多入口涡流混合器沉淀法
传统沉淀法中溶剂和反溶剂混合所需时间较长,而受限液体撞击射流(confined liquid impinging jet, CLIJ)沉淀和多入口涡流混合器(multi-inlet vortex mixer, MIVM)沉淀能大大缩短沉淀所需的时间。CLIJ 和 MIVM是由微射流反应技术发展而来的两种方法。CLIJ 过去常常研究其热传递特性,直到 2005 年以后,CLIJ 才被应用于纳米化合物的沉淀[16]。如图 3 为 CLIJ 沉淀法示意图,药物溶液直接撞击反溶剂,当两股液体射流混合时,反溶剂会使药物沉淀成细小颗粒。在这个过程中,射流的流体在高速产生的高剪切力作用下扩散并分裂成薄膜,促进液体之间的强烈微观混合,该过程中的微观混合时间估计小于 1 ms[17]。注意纳米晶颗粒必须要在离开混合区之前形成,否则收集的混合物可能会在静置期间形成不符合要求的颗粒,进而影响产率。CLIJ 法已成功用于制备粒径为 53 nm 的氯雷他定、粒径为 55 nm 的胡萝卜素、粒径为 300 nm 的环孢素和硫酸沙丁胺醇等纳米颗粒[17-19]。CLIJ 法要求液体射流流量相同,Liu 等[20]于 2008 年提出的 MIVM 则允许不同流量的液体混合。如图 4 为 MIVM 的原理图,1个入口连接药物有机溶液,其他3个入口连接加有稳定剂的水相。药物溶液和反溶剂在泵内快速充分混合,使短时间内溶液中的饱和度过高,引发快速成核。四流 MIVM 通过改变单个流的流量来控制过饱和度和溶剂组成,进而有效地控制颗粒的生长。此技术能够对工艺条件进行精确的控制,使悬浮液快速混合。但是此法不适合亲水性药物的制备,工业生产中也难以扩大规模[21]。利用 MIVM 技术已经获得了粒径为 20 nm 的姜黄素、粒径为 100 nm 的熊果酸及粒径为 317nm 的环孢素等纳米药物[22-25] 。
2.4 冷冻干燥过程中控制结晶
冷冻干燥过程中控制结晶(controlling crystallization duringfreeze-drying, CCDF)是于 2008 年由 de Waard 等[26]发明的一种新兴的纳米晶制备技术。首先需要制备两种溶液—低水溶性的药物在叔丁醇中的溶液和基质(甘露醇)在水中的溶液,然后将两者混合、冷冻、升温和干燥。混合后必须立即快速冷冻,以防止药物过早结晶,从而形成太大的药物晶体[27]。de Waard 等[28]以非诺贝特为模型药物利用在线拉曼光谱对此过程进行了跟踪,发现溶剂结晶发生在冷冻过程中,而溶质结晶发生正在升温和干燥步骤之间。控制较高的冷冻速率和较低的储存温度都有利于较小粒径纳米晶体的形成。目前此法只限于小规模实验室的应用,其用于大规模生产的可行性还需进一步研究。Zhai 等[29, 30]通过优化CCDF 过程中溶剂组成、药物浓度和冻干温度等条件,制备出了生物利用度有明显提升的黄体酮纳米晶,说明 CCDF 有一定的应用前景。
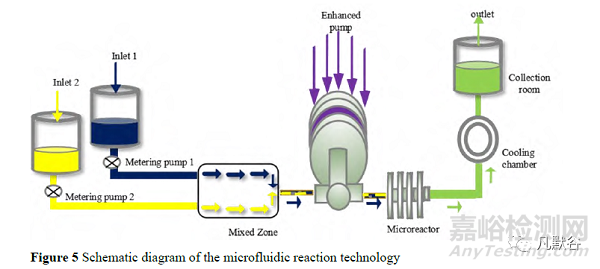
2.5 微射流反应技术
微射流反应技术(microfluidic reaction technology, MRT)是 2010 年由 Microfluidics 公司发明的一种利用喷射流原理缩小晶体尺寸的方法,是近年研究的热点。装置主要由计量泵、强化泵、微反应器和冷却装置构成。如图 5,反溶剂和药物溶液经进料口加入,两者的比例经计量泵控制,在混合区两者进行初步混合,形成的混悬液以预定的速度流入强化泵,强化泵对流入的混悬液加压,达到指定压力后,混悬液通过喷嘴以超高速迸射进入微反应器。在微反应器内,喷射流相互碰撞,在强烈的空穴效应和剪切效应下颗粒粒径减小[31]。为了降低由于黏性能量耗散而在加工过程中升高的流体温度,产物在最终进入收集室前会先进入冷却装置[32]。反应物在进入微反应器之前会有一些混合,但是由于流体的接触持续时间很短(<1 s),且流动为层流,混合保持在最低限度。反应器内液体的混合强度比反应器前的混合强度高一个数量级。微流体反应技术最大的优点是能够连续化和规模化生产纳米晶体,并且制得的产品粒径较均一,但是此法仍然存在能量消耗大和通路易堵塞的缺点。Aghajani 等[33]利用人工神经网络建模,确定在溶剂温度较高、流速较低,而反溶剂流速较高时,所得的纳米晶悬浮液的多分散性指数(polydispersity index, PDI)较低。达那唑[34]、氢化可的松[35]、头孢呋辛酯[36]和阿托伐他汀[37]等纳米晶均可采用微射流反应技术制备。
2.6 利用酸碱反应产生的 CO2 辅助沉淀法
利用酸碱反应产生的 CO2 辅助沉淀是于 2016年由 Han 等[38]提出的一种利用化学反应产生的外部能量来减小药物粒径的方法。此法不需要任何特殊的能量输入设备,操作简单易行。首先利用有机溶剂与有机酸和稳定剂一起溶解难溶于水的药物,然后将溶液旋转蒸发干燥得到酸相,最后加入碳酸盐水溶液,溶液发生酸碱反应快速生成 CO2 气泡,所生成的 CO2 气泡起快速微观混合作用,而稳定剂同时吸附在药物的疏水表面,能够抑制纳米晶的聚集,实现药物的纳米悬浮。Wang 等[39]将姜黄素、稳定剂和酸溶解在有机溶剂中,旋转蒸发干燥得到酸相。在酸相中加入碳酸盐溶液,得到粒径约 100 nm 的姜黄素纳米悬浮液。Wang 等[40]利用此法制备了粒径为 302.8 ± 2.0 nm 的他克莫司纳米悬浮液。Kathpalia 等[41]发现,与利用反溶剂沉淀法制备的产品相比,用此法制备的atovaquone 纳米悬浮液的药物粒径更小,溶解度更大。
3、组合技术
3.1 Nanoedge 技术和 H69 技术
Nanoedge 技术是沉淀法和高压均质法等高能技术的组合技术,是 Baxter 于 2003 年提出的首个用于生产纳米晶的组合技术。操作时先将药物溶解在有机溶剂中,再与水性溶剂混合,药物因为在水性溶剂中溶解度低而形成半晶型或无定型沉淀,之后将形成的沉淀利用高压均质法等高能技术增强其结晶度,形成更加稳定的结构[42]。该技术在一定程度上能够解决沉淀法制得的纳米晶的稳定性问题,并改善高能技术的粒度减小效果。此法已成功用于制备粒径约为 300 nm 的奈韦拉平[43]、粒径为 100~200 nm 的两性霉素 B[44]、粒径为 200 ±4 nm 的联苯双酯[45]和粒径为 173.21 ±0.9 nm 的槲皮素[46]等纳米混悬液。
在理想情况下,Nanoedge 方法中沉淀和高压均质步骤之间的时间应尽可能短,以获得更小粒径的纳米晶,最好直接在均质机的扩散区内进行沉淀。Mueller 及其同事于 2006 年发明的 H69 技术可以做到在微量沉淀形成纳米晶的同时有高压均质的空化力作用于药物颗粒[47]。操作时先将药物溶解在溶剂中,然后与水性非溶剂混合,两种液体接触时会产生沉淀,颗粒形成发生在均质机的高能区,空化和剪切力立即作用于新形成的药物颗粒,使粒径减小[9]。Li 等[48]利用 H69 技术制得了熊去氧胆酸纳米晶体,他们发现,与单用高压均质法相比,组合技术可以显著提高粒径减小效率。Sinha 等[49]利用 H69 技术制备了粒径为 304 nm 的布洛芬纳米晶体。H69 工艺能够制得单靠高压均质无法生产的 100 nm 以下的纳米晶药物。Moeschwitzer 等[47]利用 H69 技术制备了粒径为 22 nm 的超小型纳米晶。
3.2 H42 技术
2005 年 Pharmasol 公司将喷雾干燥法和高压均质法两种技术相结合用于纳米晶药物的制备,即为 H42 组合技术。Sosnik 等[50]发现,喷雾干燥后的药物粉末通常具有不同的物理性质—粒度更小、结构更多孔,这在一定程度上降低了后续处理过程中均质器堵塞的风险。此外,喷雾干燥技术得到的粉末具有更好的流动性,且过程不涉及高能耗的冷却工艺,所以此法成本较低,适合大批量生产药物。但是传统的喷雾干燥技术容易导致产品在干燥室壁中的损失,不适合小规模实验室的应用。Liu 等[51]将白藜芦醇分别使用标准高压均质法和 H42 组合方法进行处理,发现组合技术制得的纳米晶粒径较高压均质法减小了 2 倍。Gao 等[52]发现,喷雾干燥后的醋酸氢化可的松在 1 500 bar 下进行一次均匀化循环所得的药物粒径小于使用研磨法进行 20 次循环后所得药物的粒径,H42 技术可使颗粒尺寸减小所需的能耗降低。
3.3 H96 技术
Moschwitzer[53]于 2006 年申请了由 H96 工艺制备的两性霉素 B 纳米混悬液的专利,制得产品的最终粒径为 62 nm。H96 技术是将冷冻干燥法与高压均质法相结合的技术[5]。冷冻干燥过程包括 3 个步骤:冷冻、一次干燥(冰升华)和二次干燥(从固相中除去水)。经过冷冻干燥处理后药物的某些物理性质会发生变化,如质地会更加疏松多孔,润湿性也会增加,在稳定剂溶液中药物分散会更加均匀。Ma 等[54]利用扫描电子显微镜(scanning electronmocroscope,SEM)观察到冷冻干燥后的药品表面为更加光滑的棒状形态。药物的这些物理性质的改变为高能技术在较短的时间内生产小粒径药物创造了条件[55]。Hu 等[30]利用 H69 技术制备了粒径为 162 nm 的核黄素纳米悬浮液。Salazar 等[55]以格列本脲为模型药物,证明了经过冷冻干燥预处理药物的粒径减小效率比未经处理的药物显著提高,H96 技术能够成功应用于生产小粒径的纳米晶体药物。
3.4 超声法联合反溶剂沉淀法
超声法以其操作简单、成本低,且超声波的能量高、穿透性好的优点而备受青睐,但是其制得的纳米晶药物的均匀性较低,将其与反溶剂沉淀法相结合可增加纳米晶药物的均匀性。超声法和反溶剂沉淀法联用时,由于超声波的空化作用,溶液会在负压阶段形成空泡。在随后的压缩阶段,形成的真空泡群会在压力的作用下破裂,释放出大量的能量和强大的冲击波,进而使溶剂和反溶剂的混合增强,同时强大的冲击波也会导致颗粒破碎,使颗粒的粒径减小[56]。Ige 等[57]通过实验发现,超声时间为 10 min 是可以减小颗粒尺寸并防止晶体生长和团聚的最佳时间。Zhang 等[58]在没有使用表面活性剂的情况下,利用超声和反溶剂沉淀法成功制备了至少 6 个月稳定的喜树碱纳米晶。Sharma 等[59]发现超声能够使沉淀法制备的替米沙坦纳米混悬液的粒径进一步降低 35%,超声和反溶剂沉淀法联用还可制得粒径为 209 ± 9 nm 的尼群地平[60]、粒径为 339 nm 的美洛昔康[61]和粒径约为 175 nm 的双硫仑[62]等纳米混悬液。
基于以上所述,表 2 列出了一些纳米晶的新型制备方法的优缺点。



4、结语和展望
目前已经有大量文献报道了纳米晶药物在生物利用度的改善方面的积极成果,纳米晶体作为难溶性药物递送系统具有巨大的潜力。为了进一步促进纳米晶药物的发展,相关的药物研发企业需集中精力优化可扩展的工艺和配方,并积极开发纳米晶药物的新型制备技术。新型制备技术的多样化为不同特性纳米晶药物的制备提供了契机。但是现有的大部分纳米晶新型制备技术本身发展仍然不成熟,还存在各种各样的问题,如用于生产的设备过于昂贵、生产过程中耗能过高等。此外,受限于技术本身扩大化发展的难度,目前大部分纳米晶新型制备技术仍然处于实验室的小规模实践阶段,其工业化扩大还面临很多阻碍,需要更深的探索。
未来在对纳米晶新型制备技术的探索过程中可适当应用“质量源于设计”(Quality byDesign, QbD)来优化纳米晶的制备工艺和处方,也可以结合人工智能网络中的深度学习,利用大数据网络对运用某技术成功制备纳米晶的处方进行筛选和归类,再结合药物本身的特点(如药物的疏水性和热敏感性等)选定针对药物的最佳制备技术。相信在不远的将来,纳米晶的制备技术会趋于完善,纳米晶会应用到更广泛的制剂领域。
作者 | 田阳,彭一凡,张志伟,张慧,高翔
军事科学院军事医学研究院毒物药物研究所

来源:药学学报


