您当前的位置:检测资讯 > 监管召回
嘉峪检测网 2021-05-10 09:32
〔摘要〕该研究通过分析 2017—2019 年国内创新医疗器械审查及医疗器械优先审批的情况,解读国家及各省出台的相关鼓励政策,探讨创新医疗器械发展的政策驱动,旨在为我国医疗器械监管与行业发展提供参考。
为贯彻落实国家《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》[1],鼓励医疗器械研发创新,国家药品监督管理局先后发布了一系列政策[2-4],以支持医疗器械新技术的推广和应用,推动医疗器械产业的高质量发展。而《创新医疗器械特别审查申报资料编写指南》等文件[5-6]的发布,进一步规范了创新医疗器械审查及医疗器械优先审批工作,提高了审查审批的效率。2018年,国家药监局医疗器械技术审评中心发布了《关于发布创新医疗器械特别审查申请审查操作规范的通告》[7],从制度上保证了创新医疗器械审查工作的科学、公正、公开、公平。基于此,本研究详细分析了2017—2019年国内创新医疗器械审查通过情况及医疗器械优先审批通过情况,并解读了国家及地方出台的相关政策,以期为国内创新医疗器械行业发展提供一定的参考。
1 国内创新医疗器械特别审查通过情况
从国家药品监督管理局医疗器械审评中心2017—2019年发布的《创新医疗器械特别审查申请审查结果公示》来看,国内通过创新医疗器械特别审查数量最多的4个省、市分别为上海、北京、广东、江苏,其中,上海的总数居于首位,北京次之,江苏和广东的总数相同,见图1。
从产品类型来看,2017-2019年通过审查的国内创新医疗器械主要集中在有源类(有源诊断治疗设备、有源植入器械)、无源植入器械及体外诊断试剂,见图2。其中,有源诊断治疗设备中,有源手术器械数量最多,而无源植入器械以各类血管支架为主,见表 1。
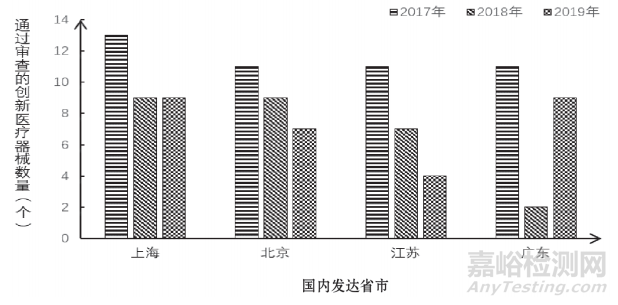
图 1 2017—2019年国内创新医疗器械特别审查通过情况
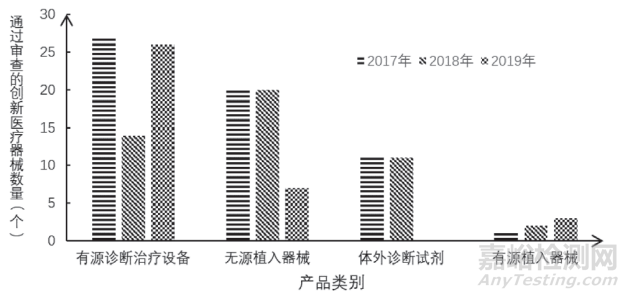
图 2 2017—2019年国内通过创新医疗器械特别审查的产品类别及数量
表1 2017—2019年国内通过创新医疗器械特别审查的产品情况

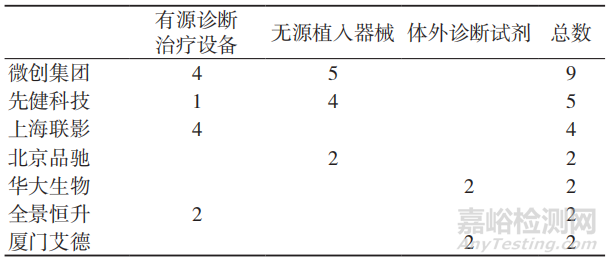
随着科技的发展与进步,我国不断涌现出越来越多的具有自主创新能力的医疗器械生产企业,其往往有多个“国际原创”或“国内首创”产品先后进入创新医疗器械特别审查通道,见表2。其中,国产心脏支架、心脏封堵器等创新医疗器械的上市,将实现对进口心血管植入类产品的替代;在磁共振设备等高端医疗器械领域,以上海联影为代表的国产品牌逐步进入高端影像市场,为国内患者提供可达到国际标准的治疗解决方案。
表2 2017—2019年国内创新医疗器械领先企业申报数量(个)
2 国内医疗器械优先审批通过情况
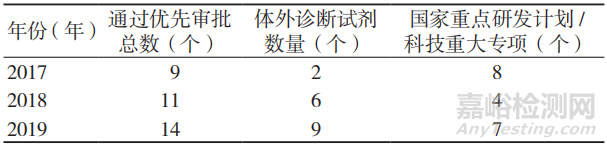
2017—2019年,全国共有34个医疗器械符合优先审批条件,其中,体外诊断试剂17个,以申报国家重点研发计划/科技重大专项的医疗器械优先审批通过率最高,占55.9%,见表 3。据国家药监局公布的数据显示,截至2020 年5月,进入医疗器械优先审批通道的34个产品中,已有18个获准上市。
表3 2017-2019年国内医疗器械优先审批情况
3 二类创新医疗器械鼓励政策
为积极响应国家创新医疗器械政策,截至2020年5月,全国共有11个省(自治区、直辖市)发布了《二类创新医疗器械特别审批(审查)程序》,其中,广东、山东于2015年即已出台有关规定,对创新医疗器械予以优先安排注册检验、体系核查、技术审评、行政审批,并由专人提前介入指导。此外,浙江、四川、海南、北京、江西、河南、西藏、上海、河北(按照政策发布时间先后顺序)9省也相继出台了鼓励企业申请创新医疗器械的优惠政策,对省内二类创新医疗器械的审批开辟了“绿色通道”,加快了审评审批速度,缩短了注册周期。
4 医疗器械注册人相关制度释放政策红利
2017年,上海自由贸易试验区开始试点医疗器械注册人制度。《中国(上海)自由贸易试验区内医疗器械注册人制度试点工作实施方案》[8]中的医疗器械注册人制度是指符合条件的医疗器械注册申请人可单独申请医疗器械注册证,然后委托给有资质和生产能力的生产企业生产,从而实现医疗器械产品注册和生产许可的“解绑”。2018年,首个按照该方案获批上市的医疗器械产品由上海远心医疗科技有限公司委托上海微创电生理医疗科技股份有限公司生产,这两家公司同属微创集团,充分体现了集团内部研发与生产资源整合的优势。目前,微创集团已有19个产品进入国家创新医疗器械注册绿色通道,成为国内领先的创新型高端医疗器械集团。
2019年,为进一步鼓励医疗器械创新,国家药品监督管理局发布了《关于扩大医疗器械注册人制度试点工作的通知》[9],将试点区域扩大至全国21个省(自治区、直辖市)。上海、江苏、浙江、安徽4省联合发布了《长江三角洲区域医疗器械注册人制度跨区域监管办法(试行)》[10],为长江三角洲区域医疗器械注册人跨区域监管提供了法规依据。医疗器械注册人制度的深化落实将进一步激发研发机构和科研人员对产品研发和技术创新的热情,在极大程度上破除医疗器械技术转化的壁垒,提升医疗器械创新投入产出的效率[11]。
5 小结
国产创新医疗器械持续、快速、健康的发展不仅需要企业不断提高自身的综合能力,同时还需要监管部门不断完善配套体制、机制,切实推进创新体制改革,使更多的国产医疗器械产品逐步替代进口产品,推动国内医疗器械产业的健康发展。
为深化供给侧结构性改革和“放管服”的改革要求,国家将加快创新医疗器械、临床急需医疗器械的审批上市,进一步激发医疗器械企业的活力和研发创造力。在创新思维的驱动下,医疗器械行业将迎来新一轮的整合升级,我国自主创新研发的医疗器械将逐步占据市场主导位置。
【参考文献】
[1]中共中央办公厅,国务院办公厅印发.关于深化审评审批制度改革鼓励药品医疗器械创新的意见[EB/OL].[2017-10-08].
http://www.gov.cn/xinwen/2017-10/08/ content_5230105.html.
[2]国家食品药品监督管理总局.关于发布医疗器械优先审批程序的公告(2016 年第168号公告)[EB/OL].[2016-10-25].
http://www.nmpa.gov.cn/WS04/CL2183/322111.html.
[3]国家食品药品监督管理总局.关于印发创新医疗器械特别审批程序(试行)的通知(食药监械管﹝2014﹞13号)[EB/OL].[2014-02-07].
http://www.nmpa.gov.cn/WS04/CL2197/324797_2.html.
[4]国家药品监督管理局.关于发布创新医疗器械特别审查程序的公告(2018年第83号)[EB/OL].[2018-11-02].
http://www.nmpa.gov.cn/WS04/CL2138/331560.html.
[5]国家药品监督管理局.关于发布创新医疗器械特别审查申报资料编写指南的通告(2018年第127号)[EB/OL].[2018-12-12].
http://www.nmpa.gov.cn/WS04/CL2138/333947.html.
[6]国家食品药品监督管理总局.关于发布医疗器械优先审批申报资料编写指南(试行)的通告(2017年第28号)[EB/OL].[2017-02-15].
http://www.nmpa.gov.cn/WS04/CL2138/300295.html.
[7]国家药品监督管理局医疗器械技术审评中心.关于发布创新医疗器械特别审查申请审查操作规范的通告(2018年第11号)[EB/OL].[2018-11-29].
https://www.cmde.org.cn/CL0050/8100.html.
[8]上海市食品药品监督管理局.中国(上海)自由贸易试验区内医疗器械注册人制度试点工作实施方案(沪食药监械管〔2017〕257号)[EB/OL].[2017-12-01].
http://www.shanghai.gov.cn/nw2/nw2314/nw2319/nw12344/u26aw54340.html.
[9]国家药品监督管理局.关于扩大医疗器械注册人制度试点工作的通知(国药监械注〔2019〕33号)[EB/OL].[2019-08-01].
http://www.nmpa.gov.cn/WS04/CL2197/339662.html.
[10]上海市药品监督管理局,江苏省药品监督管理局,浙江省药品监督管理局,等.关于发布长江三角洲区域医疗器械注册人制度跨区域监管办法(试行)的通知(沪药监械管﹝2020﹞67号)[EB/OL].[2020-02-13].
http://yjj.sh.gov.cn/zx-ylqx/20200310/ 5ae93c31a94a4faa904de0fba 420b634. html.
[11]蒋海洪,李晶.基于实例的医疗器械上市许可持有人制度分析[J].中国医药工业杂志,2018,49(8):1177-1181.

来源:Internet


