您当前的位置:检测资讯 > 行业研究
嘉峪检测网 2021-04-08 17:34
近年来新药临床开发的成功率有减无增,成本却飙升得厉害,2014年平均成本已达26亿美元(PhRMA2016,计算失败产品),因此寻找廉价而成功率高的“另类新药”,成为药企们老生常谈的话题。近年来,越来越多的“另类新药”进入人们的视野,笔者在此带领大家一起来了解“老外们”另辟的蹊径。
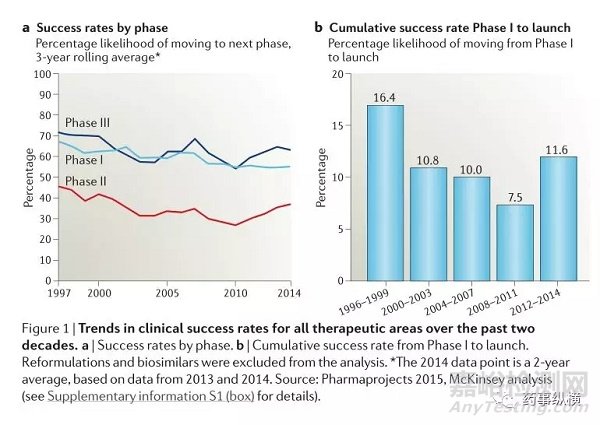
新药临床开发成功的概率与趋势(nature)
1. 老药新用
老药新用是指对一些已经上市的老药进行二次定位,开发新的适应症,使僵死的老药焕发出青春。自Celgene的沙利度胺成功上市以来,老药新用这种策略渐渐进入人们的视线。自此,臭名昭著的反应停不仅成为老药新用的成功典范,还成为Celgene做大、做强的关键基石。近年来,老药新用成功的案例越来越多,光2017年就获批了三个这样的产品。
地夫可特
2月9日,FDA批准Emflaza(deflazacort)用于杜氏肌营养不良症(DMD)治疗。DMD是一种罕见病,全球平均每 3500个新生男婴中就有一人罹患此病,绝大多数患儿会在 20 岁或30岁因并发症死亡。DMD是一个治疗方案非常缺乏的疾病,FDA因在去年批准了差强人意的Exondys 51,而被推倒风口浪尖。Deflazacort 是一个上市多年的糖皮质激素,因为疗效不够出色已经被人遗忘,经Marathon Pharma 公司重新定位以后“枯木逢春”。临床试验数据显示,196 名患者使用 Emflaza 肌肉力量有所改善,与安慰剂组相比,Emflaza 0.9mg/kg/天治疗组平均肌力从基线实现显著更大幅度的增加(p=0.017)。
依达拉奉
5月5日,FDA首次批准了依达拉奉上市,用于肌萎缩侧索硬化治疗(ALS)。ALS俗称渐冻人症,在美国有1.2-1.5万名ALS患者,治疗方案也非常匮乏,FDA 此前批准了利鲁唑,但只能增加约10%的一年生存机会。依达拉奉在日本、中国已经上市十几年,但是早期适应症是卒中。因为欧美没有获批该适应症,中国被戏称为“神药”。此次依达拉奉获批ALS,对ALS患者而言是莫大的福音,对于中国“神药”而言,提供了一个活下去的理由。临床数据显示,在标准疗法基础上加入依达拉奉能显著改善ALS患者综合功能指标ALSFRS-R(-5.0 VS-7.5),同时运动、呼吸等局部功能也获得了改善。
鹅去氧胆酸
4月10日,EMA批准鹅去氧胆酸用于先天性胆固醇27羟化酶缺乏的原发性胆汁酸合成障碍患者治疗。鹅去氧胆酸在中国和日本获批的适应症均为胆固醇性胆结石症,已经是老得不能再老、几近淘汰的药物。但欧洲是首次获批的鹅去氧胆酸,美国尚未获批。对于患者而言是福音,对于企业而言是机遇。
从以上产品不难看出,老药新用获批的适应症主要是罕见病,这些新适应症有的是医生在临床用药中偶然发现的,也有的是通过信息通路二次筛选出来的。对于前一种情况,获得专利保障的难度较大,而后一种情况则需要有大量的分子筛选经验。目前老药新用的定位已经不再完全局限于罕见病,目标分子也不再局限于已经上市的老药,临床试验失败的药物分子、临床前药理与药效剔除的分子,甚至是文献曝光而未开展临床试验的分子都是药企们物色的目标。
相比设计全新的分子,“老药”分子化学结构、理化性质已知、药理毒理已知、PK参数已知,可以省去大量的初期研发费用。因此这种省钱的研发方式有望成为新药研发的新常态,据笔者所知,很多药企或数据库运营商已经在开始建立自己的化合物分子库,供研发人员通过计算机模拟,对信号通路中的靶点进行再匹配,以开发新的适应症。
2. 老药新批
老药新批是将一些在世界范围内已经上市的老药到没有批准该产品的国家申请上市,老药新批可以将一个老药连适应症都不变地包装成“新分子实体”,是不折不扣的廉价新药。
然而,老药新批也要开展临床试验,而且适应症、化合物都无法获得专利保护,唯一可享受的就是数据保护期。在这种模式运行之前,我们必须了解每个药物在各国的获批情况,专利期保护期,潜在用药需求等等。2017年成功案例有5个,分别为苄硝唑、赛克硝唑、曲恩汀、氮芥和多硫戊聚糖钠。
苄硝唑
8月 29 日,FDA 批准苄硝唑(benznidazole)用于2-12 岁儿童查加斯病(Chagas disease)治疗。查加斯病是一种由克氏锥虫引起的寄生虫感染,能够通过不同路径传染,美国大约有 30 万人患者。临床试验数据显示,服用苄硝唑的儿童抗体测试从阳性转为阴性比例为 60%,安慰剂组该比例为14%;另一项试验的成果也相似,大约 55% 服用苄硝唑的儿童抗体测试转为阴性,而安慰剂组只有 5%。苄硝唑早在上世纪70年代就已经开始使用,但此前美国并未批准本品,经过Chcem Reseach的二次定位,连适应症都未改就摇身一变成为“新分子实体”。
赛克硝唑
9 月 15 日,FDA 批准了 Symbiomix 公司的 Solosec(secnidazole),用于成年女性的阴道炎治疗。Secnidazole是 5-硝基咪唑类抗生素,是唯一一款治疗细菌性阴道炎的单剂口服疗法。在临床试验中,经 21-30 天的本品或安慰剂治疗,试验1/2的临床响应率分别为 67.7% 和 53.3%,而相同条件下,安慰剂只有 17.7%和 19.3%。尽管本品早在70年代就已经在葡萄牙上市,中国也批准了本品用于阴道炎治疗,但在美国获批还是首次。细菌性阴道炎是美国最常见的妇科感染,每年影响了2100万名14-49 岁的女性,因此本品具有不错的市场前景。
氮芥
3月3日,EMA批准Ledaga(chlormethine)凝胶剂用于蕈样肉芽肿型皮肤T细胞淋巴瘤局部治疗。260名蕈样肉芽肿型皮肤T细胞淋巴瘤患者参与的临床试验数据显示,接受Ledaga治疗至少6个月的患者中,有77%的患者在病变严重程度指数综合评估(CAILS)得分方面实现了临床缓解(CAILS得分从基线改善50%以上),其中19%的患者完全缓解,对照组实现临床缓解的患者比例为59%,其中15%的患者完全缓解。众所周知,氮芥是一种毒气,在一战中就已经广泛使用,FDA的最早批准日期是1949年,但EMA此前并未批准过氮芥上市。
多硫戊聚糖钠
6月2日,EMA批准Elmiron(pentosan polysulfate sodium)用于膀胱疼痛综合征治疗。多硫戊聚糖钠是一种结构类似于GAG的药物,口服以后部分经尿中排出,有助于膀胱上皮结构与功能的恢复。美国早在1996年就批准了Elmiron,目前专利已经到期,因为没有仿制,被FDA列入鼓励仿制的清单。尽管如此,EMA此前并未批准过该产品。
曲恩汀
9月5日,EMA批准Cuprior(trientine)用作威尔逊氏病(Wilson’sdisease,也称作肝豆核变性)治疗。该产品早在1985年就已经获得FDA批准,中国也批准了该产品用作肝豆核变性治疗,但EMA并未批准该产品。对于这个孤儿药产品,EMA还开了绿灯,Cuprior仅仅做了PK就获得批准上市(EMA审批意见中提到有欧洲国家在1985年批准过曲恩汀,所以没有要求临床数据)。
3. 聚乙二醇修饰
使用聚乙二醇简单地修饰药物分子,可改变药物分子的理化性质和药动学特征。2014年FDA批准阿斯利康的纳洛西酮(Movantik)用于阿片受体激动剂引发的便秘(OIC)。众所周知,激动中枢阿片受体可产生镇痛的药理效应,但激动外周阿片受体可降低肠蠕动引起便秘。OIC是长期服用阿片药物患者经常遇到的问题,尤其是癌症患者。纳洛酮是一种非选择性阿片受体阻断剂,但通过短链聚乙二醇修饰后分子因极性大幅增加而无法通过血脑屏障,可对外周阿片受体实现选择性阻断。这样修饰后的纳洛酮不但不会影响阿片受体激动剂的止痛效果,还可以有效缓解便秘。
尽管此前FDA批准了甲基纳曲酮,但不良反应较大,市场销售不理想,2016年总销售额仅5000万美元。相比之下,聚乙二醇修饰的纳洛酮更受欢迎,2016年的总销售额已经超过1亿美元,2017年光阿斯利康公开的销售额就已经达到1.22亿美元,而全球销售额有望突破2亿。除了纳洛西酮,在临床研究中的药物还有PEG修饰的伊立替康(phase 3)。
相比引入新官能团,PEG修饰的药物主要改变的是药动学特征,药理毒理变化不大,在开发之时可以节省很多的成本,但是在分子设计之时必须找到相应的临床需求。
4. 氘代药物
氘代药物的原理是针对体内药物代谢中涉及到碳氢键断裂的药物进行改进。氘,即重氢,氘与碳构成的键比普通氢与碳构成的键更坚固,人体的关键代谢清除途径之一依靠的是分解碳氢键,许多情况下,用氘替药物中的少数氢原子能减缓碳氘键被酶分解,可在体内停留更长时间,同时减少有毒代谢产物的形成。因此,一般来说,相比于未氘化药物,氘代药物有降低毒副作用、增加药物稳定性、增强疗效、延长药物生物半衰期等作用(同写意,程元伟)。
2017年首个氘代药物 Austedo(deutetrabenazine)获得FDA批准,用于舞蹈症的治疗。Austedo的成功为氘代药物的发展奠定了基础,分析师预测该产品的销售额可达5亿美元。氘代是突破化合物专利最简单的方式,也是最能规避新药研发风险方式。Concert Pharma是最早研发氘代药物的公司之一,截止目前,该公司已经合成出多个氘代药物。国内方面,专注氘代药物的公司也不少,相信在不远的将来,可能有越来越多的药物与我们见面。
5. 手性拆分
手性拆分也是获得廉价新分子实体的一种方式,但是近年来上市的新药均是已经拆分研究过的,因此我们的目标只能定位在90年代及以前上市的药物。尽管在此期间上市的分子有1000多种,但要找到合适的拆分目标却不容易。第一,很多90年代以前上市的药物已经被淘汰,不再存在广泛的治疗需求;第二,有拆分机会的药物,原研公司已经进行了拆分或者在化合物专利中进行了保护,如艾司西酞普兰、埃索美拉唑、左西替利嗪、左氧氟沙星等等;第三,有的药物左旋体和右旋体之间不只存在药效强度的差异,药理学机制都不一样,比如奎宁(治疗疟疾)与奎尼丁(心律失常)。
即便如此,但也有漏网之鱼。印度Emcure Pharma就是一家专注手性药物开发的公司,该公司已经拆分了多个单体,比如左氨氯地平、右雷贝拉唑等。尽管这些产品相比消旋体没有带来质的飞越,但在一定程度上降低了用药剂量。对于这种低成本的“新分子实体”,不但能够避开仿制药的竞争,还有望成为中国新药走向世界的一条捷径。
小结
笔者列出以上五种开发低成本“新分子实体”途径仅仅只是抛砖引玉,望广大读者取其精华去其糟粕。在此笔者也想说一句,不要低估我们的智商,老外能做到的我们应该也能做到,思想有多远路就能走都多远,不是我们做不到而是我们想不到,跳出仿制的圈子,祝广大读者早日取得成功。

来源:Internet


