您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2021-03-16 08:32
吻合器包括壳体、中心杆及推管,中心杆设在推管内,中心杆前端装有钉盖,后端通过螺杆与壳体尾部的调节旋钮连接,壳体外表面上设有激发手柄,激发手柄通过铰链与壳体活动连接,其特征在于:所述吻合器内设有连杆机构,三根连杆分别与激发手柄、壳体内壁及推管连接,且三根连杆的一端均连接在同一活动铰链上;连杆机构的三根连杆包括动力杆、支撑杆及运动杆;动力杆与激发手柄为铰接;支撑杆与壳体之间为活动铰链连接;运动杆与推管之间为活动铰链连接。
首个吻合器的出现
吻合器是世界上首例缝合器,用于胃肠吻合已近一个世纪,直到1978年管型吻合器才广泛用于胃肠手术。一般分为一次性或多次使用的吻合器,进口或国产吻合器。它是医学上使用的替代传统手工缝合的设备,由于现代科技的发展和制作技术的改进,目前临床上使用的吻合器质量可靠,使用方便,严密、松紧合适,尤其是其缝合快速、操作简便及很少有副作用和手术并发症等优点,还使得过去无法切除的肿瘤手术得以病灶切除,很受国内外临床外科医生的青睐和推崇。
吻合器分类
吻合器是医学上使用的替代手工缝合的设备,主要工作原理是利用钛钉对组织进行离断或吻合,类似于订书机。五花八门的应用功能,也为了利于用户区分和对吻合器的管理,药监局在规定吻合器产品注册名时,也给出了推荐的规范性品名(如下图)。根据适用范围不同,主要可分为皮肤吻合器、消化道(食道、胃肠等)圆形吻合器、直肠吻合器、圆形痔吻合器、包皮环切吻合器、血管吻合器、疝气吻合器、肺切割缝合器等。你管产品是哪种吻合器,注册时都可以按照如下要求进行。
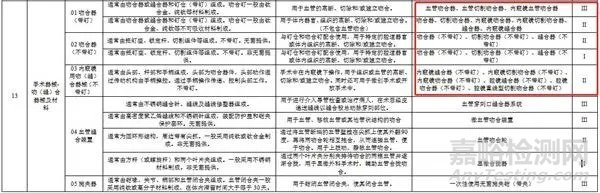
吻合器产品注册
上图看到吻合器有一类,也有二类,那么应该如何注册呢?
一类吻合器产品备案流程、周期、资料和费用说明
1、一类吻合器备案流程:一类吻合器生产厂家,需要提供一份产品的自检报告,到企业所在地的市药监局或政务服务大厅药监窗口递交备案资料,当日即可领取一类医疗器械产品备案凭证。目前部分地市可委托下属区局、县局代为备案,具体请咨询药监管理部门。
2、一类吻合器备案周期:一类吻合器备案周期,从自检报告出来后,到领取产品备案凭证和生产备案凭证,需要一个半月左右时间。
3、一类吻合器备案资料:(1)备案表;(2)产品风险分析资料;(3)产品技术要求;(4)成品检验报告;(5)临床评价资料;(6)生产制造信息;(7)产品说明书及最小销售单元标签样稿;(8)证明性文件;(9)符合性声明;(10)法人授权委托证明。
4、一类吻合器备案费用:药监部门不收取任何费用。
附一类吻合器生产备案资料:(1)填写打印《第一类医疗器械生产备案申请表》;(2)营业执照复印件;(3)法定代表人、企业负责人身份证明复印件;(4)生产、质量和技术负责人的身份、学历或职称证明复印件;(5)生产管理、质量检验岗位从业人员、学历职称一览表;(6)生产场地的证明文件;(7)主要生产设备和检验设备目录;(8)质量手册和程序文件目录;(9)工艺流程图;(10)所生产产品的医疗器械备案凭证及技术要求复印件;(11)授权委托书;(12)申报材料真实性自我保证声明。
二类吻合器产品注册流程、周期、资料和费用说明
1、二类吻合器注册流程:二类吻合器注册前需拿样品到具备CMA检测资质的医疗器械检测所送检,推荐到药监局认可的53家医疗器械检测所(如下图)。检测所老师依据吻合器产品技术要求对产品参数、外观等检测项进行检测,通过后出具医疗器械检测报告(该报告是医疗器械注册的前提,在递交注册资料时会用到)。二类吻合器处于免临床目录内,就不考虑临床试验流程,跳过,直接进入到体系环节。该环节需要依据医疗器械生产质量管理规范的要求进行,包括厂房的布局规范、体系文件的规范化、药监老师体考环节和问题回答等等。最后才是注册资料递交。

2、二类吻合器注册周期:从注册检验报告出具后,到领取吻合器注册证和生产许可证,大致需要6-8个月时间。
3、二类吻合器注册资料:(1)境内医疗器械注册申请表;(2)资格证明;(3)产品技术要求;(4)安全风险分析报告;(5)适用的产品标准及说明;(6)产品性能自测报告;(7)医疗器械检测机构出具的产品注册检测报告;(8)医疗器械临床试验资料;(如需)(9)医疗器械说明书;(10)产品生产质量体系考核(认证)的有效证明文件;(11)申请人应当对其所提交材料真实性的自我保证声明:(12)申请人不是法定代表人或负责人本人,企业应当提交《授权委托书》2份;(13)按申请材料顺序制作目录,如需提交软盘的,一并提交有效的软盘资料。
4、二类吻合器注册费用:各省药监部门收费各不相同,0-7万不等。
吻合器产品注册证书

吻合器注册证代码讲解
以上图注册证编号:湘械注准2017 2 09 0176为例,其中“2017“代表该产品首次注册年份;“2”代表该器械为二类医疗器械;“09”代表该器械在新版医疗器械分类目录中处于09物理治疗器械范畴;“0176”代表该器械的注册流水号为0176。
吻合器注册送检数量
通常情况下,无菌或耗材注册送检数量按照技术要求全检量的2-3倍送,也就是说技术要求全部性能检一遍,如果需要3个吻合器,那送检数量就是6-9个。(提醒:大型设备一般是一台,最多每个型号一台。)
吻合器注册需要做临床试验吗?
不需要,前文已经说过二类吻合器属于免临床产品,而一类吻合器压根不需要临床试验。
吻合器生产企业从建厂到投产销售全流程:
1、环评建厂;
2、厂房设备;
3、GMP质量体系导入(我方协助);
4、样品准备(您方);
5、注册送检(您方到检测所)约2-3个月,我方协助写送检技术要求。
6、产品注册(我方协助)约4-6个月;
7、产品GMP验收(我方协助);
8、生产许可证办理(我方协助)约2-3个月。
9、生产成品,投放市场。

来源:飞速度CRO咨询服务


