您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-01-06 15:25
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「 本文共:14条资讯,阅读时长约:3分钟 」
今日头条
国内药讯
1.山东罗欣替戈拉生片申报上市。山东罗欣与韩国CJ HealthCare Corporation联合开发的1类新药替戈拉生片的上市申请获CDE受理,用于治疗糜烂性食管炎。替戈拉生片是钾离子竞争性酸阻滞剂类药物(P-CAB),其抑制酸分泌的作用机制为竞争性结合壁细胞内 H+/K+-ATP 酶(质子泵)的钾离子结合部位。与质子泵抑制剂(PPI)不同,P-CAB 可直接抑制 H+/K+-ATP 酶,而无需在强酸环境下活化。而且,无论 H+/K+-ATP 酶活化与否, P-CAB 均可与之结合。
2.亚盛Bcl-2抑制剂获FDA孤儿药资格。FDA授予亚盛医药在研原创新药APG-2575孤儿药资格,用于治疗急性髓系白血病(AML)。这是继华氏巨球蛋白血症(WM)、慢性淋巴细胞白血病(CLL)、和多发性骨髓瘤(MM)适应症之后,APG-2575获得的第4个FDA授予的孤儿药资格。APG-2575是一款新型口服、具有高度选择性的Bcl-2小分子抑制剂。APG-2575作为单药或联合疗法,正在全球推进包括多个血液肿瘤适应症的临床开发。
3.绿叶制药长效微球制剂LY03009澳洲启动临床。绿叶制药自主研发的微球注射剂LY03009在澳洲启动I期临床试验。LY03009是一款长效制剂,每月给药一次,用于治疗帕金森病和中至重度不宁腿综合征。该新药具有持续多巴胺能刺激的优点,从而减少运动并发症的风险,延迟了帕金森病治疗中左旋多巴的引入。此外,夜间持续有效药物水平可改善夜间症状控制和唤醒功能。
4.加科思SHP2抑制剂联合用药临床在中美获批。加科思药业在研SHP2抑制剂项目(JAB-3068和JAB-3312)与PD-1/L1药物联合用药的临床试验在中美两国获批,其中,NMPA批准JAB-3068与PD-1/L1药物联合使用,用于晚期实体瘤患者的Ⅰb/Ⅱa期临床研究。FDA批准JAB-3312与PD-1/L1或MEK抑制剂联合使用,用于晚期实体瘤患者。值得一提的是,这两款新药均已获得FDA授予用于食道癌(包括食管鳞状细胞癌)治疗的孤儿药资格,目前它们正在多项临床中评估单药和联合用药的潜力。
5.思路迪获得一款CD3/PD-L1双抗大中华区独家授权。思路迪医药与Y-Biologics公司就Y-Biologics一款CD3/PD-L1双抗YBL-013达成合作协议。根据协议,思路迪医药将获得YBL-013在大中华区的独家开发,生产和商业化权利以及YBL-013在全球其他区域的共同开发或优先受让权。Y-Biologics将承担YBL-013部分IND开发费用,并将获得200万美元的签约款,可能高达8500万美元的里程碑付款,以及授权区域这款新一代肿瘤免疫治疗创新药的销售分成。
6.圣湘生物核酸检测试剂可快速鉴别新冠变异病毒。近日,圣湘生物宣布研发出快速新冠突变病毒鉴别检测试剂盒,可用于鉴别B.1.1.7新冠病毒株。该试剂可实现1小时内鉴别区分新突变毒株B.1.1.7和非突变毒株。目前,圣湘生物已上市的新冠核酸检测试剂盒已可覆盖B.1.1.7突变毒株检测。2020年12月14日,英国向世卫组织通报出现新的B.1.1.7新冠病毒株。《科学》杂志刊文称,变异病毒传播能力要比原始毒株高70%左右。
国际药讯
1.Ambrx创新ADC药物获FDA快速通道资格。FDA授予Ambrx公司HER2抗体偶联药物(ADC)ARX788快速通道资格,作为单药用于已接受过一种或多种抗HER2治疗的晚期或转移性HER2阳性乳腺癌患者。ARX788是一款利用Ambrx独有的非天然氨基酸技术进行优化的、具有高度稳定的HER2抗体偶联药物,有望降低此类药物常见的毒副作用。在中国,浙江医药旗下新码生物拥有ARX788的中国权利。
2.Provention Bio创新CD3抗体获FDA优先审评资格。FDA受理Provention Bio公司CD3单抗teplizumab用于延迟或预防高危个体的临床1型糖尿病(T1D)的生物制品许可申请(BLA),并授予其优先审评资格,预计在今年7月21日之前做出回复。如果获批,teplizumab有望成为首个改变1型糖尿病疾病进程的获批疗法。在一项Ⅱ期临床中,与安慰剂相比,teplizumab治疗组患者被诊断为1型糖尿病的中位时间为48.4个月(vs24.4个月);将1型糖尿病发病风险降低了59%。
3.基因泰克抗TIGIT抗体获FDA突破性疗法认定。罗氏旗下基因泰克公司TIGIT靶向免疫疗法tiragolumab获FDA突破性疗法认定(BTD),拟用于联合阿替利珠单抗一线治疗肿瘤PD-L1高表达且无EGFR或ALK基因组肿瘤畸变的转移性非小细胞肺癌(NSCLC)患者。本次认定基于Ⅱ期临床CITYSCAPE的积极数据:与阿替利珠单抗单药治疗相比,联合用药显示总缓解率得到改善(37%vs21%),疾病恶化或死亡风险(无进展生存期PFS)降低42%。Tiragolumab是首个获FDA授予BTD的抗TIGIT分子。
4.Calithera谷氨酰胺酶抑制剂肾细胞癌临床失败。美国Calithera公司谷氨酰胺酶抑制剂telaglenastat (CB-839)治疗肾细胞癌(RCC)的Ⅱ期临床Cantata错过试验一级终点。该研究招募444例二线以后RCC患者,在Cabometyx治疗背景下比较telaglenastat与安慰剂对无进展生存期的影响。结果显示,两组患者的无进展生存期未能达到统计显著区分(9.3个月vs9.2个月)。目前,CB-839还在一项临床试验Keapsake中评估与K药联合治疗KEAP1/NRF2变异肺癌的潜力。
医药热点
1.北京天坛医院神经外科意识障碍病区正式开科。1月4日,首都医科大学附属北京天坛医院神经外科意识障碍病区正式揭牌开科。这个病区将主要面向俗称“植物人”的意识障碍患者,开展意识障碍的意识评估、诊断与预后预测;采用手术、药物、神经调控及脑机接口等综合治疗手段,最大限度实现意识恢复、神经功能改善。该病区为国内首个围绕救助意识障碍患者开诊的专属病区。
2.五省市为海南代培住院医师。海南省卫健委印发《住院医师规范化培训五省(市)代培实施方案》。海南省计划每年选送200名住院医师参加代培,其中选送北京、上海各50人(其中临床医师各35人,中医医师各15人),四川40人(临床医师),湖南、湖北各30人(临床医师)。代培医师享受每人3万元/年中央财政补助、0.6万元/年省财政补助,其在省外培训期间的工资、社保、人事管理、培训补助、住宿补贴等由委派单位按照本单位同等条件人员标准发放。
3.北京:对入境进京人员实施“14+7”健康管理。在北京市新冠病毒肺炎疫情防控工作第202场新闻发布会上,北京市政府新闻发言人徐和建介绍,近期,北京及全国多个城市相继出现入境人员在结束14天集中观察后确诊并引发本土病例的突出情况。为切实防范超长潜伏期感染者所引发的疫情风险,确保首都防疫安全,首都严格进京管理联防联控协调机制决定对入境进京人员实施“14+7”健康管理措施。
股市资讯
【复星医药】复宏汉霖与Intas签订《License Agreement》,合作达成正式协议。复宏汉霖拟授予Intas子公司Accord的HLX-02在美国、加拿大独家商业化及相关权利的许可,付款安排包括2700万美元首付款+不超过1300万美元研发注册里程碑付款+销售里程碑付款+18%-50%的销售提成。
【科伦药业】盐酸氨溴索注射液通过仿制药一致性评价。
【兴齐眼药】(1)玻璃酸钠滴眼液上市申请获受理,适应症为干眼症及缓解干眼症状。(2)贝美前列素滴眼液上市申请获受理,适应症为降低开角型青光眼及高眼压症患者的眼压。
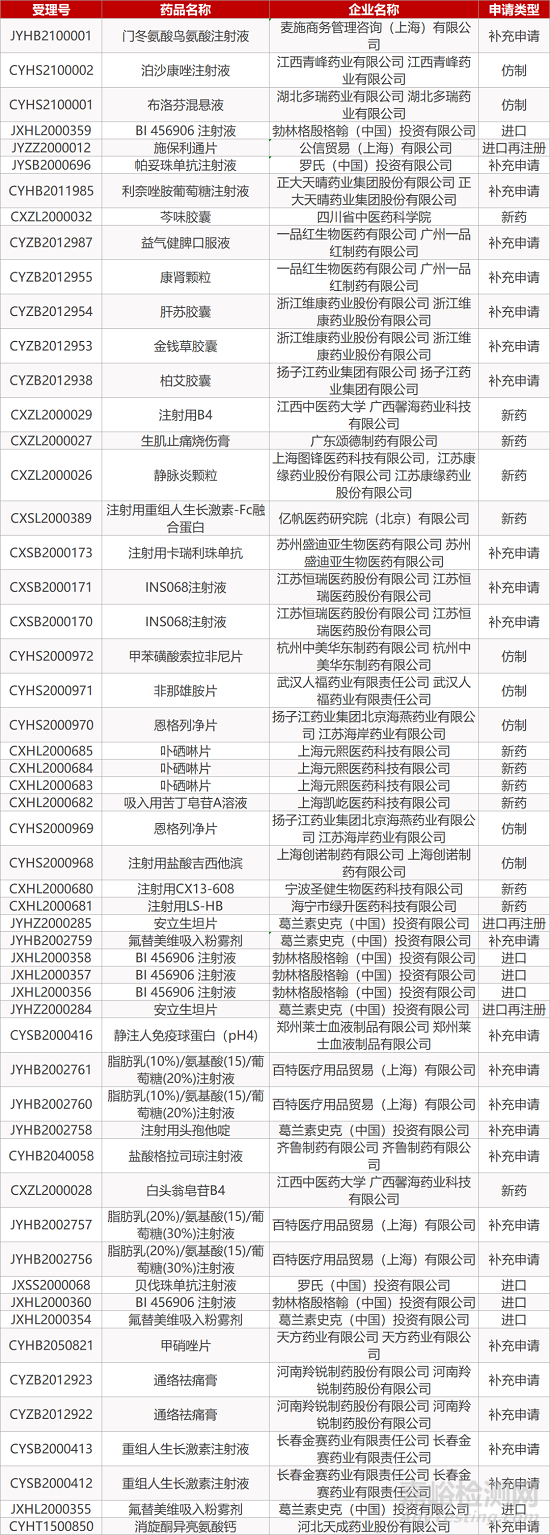
审评动向

- The End -

来源:药研发


