您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-08-04 10:08
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「本文共:15条资讯,阅读时长约:3分钟 」
今日头条
国内药讯
1.阿斯利康艾司奥美拉唑钠在华获批新适应症。阿斯利康耐信®针剂(注射用艾司奥美拉唑钠)获国家药监局批准用于预防重症患者应激性溃疡出血。作为原研质子泵抑制剂,注射用艾司奥美拉唑钠这一新适应证获批为我国应激性消化道出血的预防提供了又一选择。在一项Ⅲ期临床中,与西咪替丁组相比,艾司奥美拉唑组患者的上消化道出血率较低(2.7%vs4.6%),而且两个治疗组的安全性特征相似,艾司奥美拉唑总体耐受性良好,未发现新的安全性问题。
2.扬子江、华润维格列汀片同日获批。扬子江药业的维格列汀片和华润赛科的维格列汀片同日获批,两家企业均是以仿制4类申报获批,视同通过一致性评价。米内网数据显示,2019年诺华的维格列汀全球销售额超过10亿美元,而在中国公立医疗机构终端维格列汀销售额达2亿元规模,同比增长超过40%。截至目前,已有豪森药业、齐鲁制药、北京泰德制药等7家国内企业获批上市,且这7家企业均已通过一致性评价。
3.振东制药多发性硬化症新药ZD03获批临床。山西振东先导1类新药ZD03胶囊获国家药监局临床试验默示许可,拟开发用于治疗多发性硬化症(MS)患者。多发性硬化症是一种免疫介导的中枢神经系统慢性炎性脱髓鞘疾病,欧美地区高加索人种具有高发特点。ZD03与MS的一线用药富马酸二甲酯具有相同的作用靶点,但ZD03的选择性更高,起效剂量更低,从而为MS的临床治疗提供更有效手段。
4.辉瑞血友病新疗法首次在华获批临床。辉瑞TFPI靶向疗法marstacimab(PF-06741086)注射液在中国获批一项临床试验默示许可,适应症为“用于≥12岁有或无抑制物的血友病A或血友病B患者中的常规预防治疗,以防止出血发作或降低出血发作频率”。Marstacimab是一款靶向组织因子途径抑制剂(TFPI)的在研创新疗法,在全球范围内处于Ⅲ期临床开发阶段,已在美国获得快速通道资格和孤儿药资格。本次是该药首次在中国获批临床。
5.12种真实世界数据可用于生成真实世界证据。8月3日,CDE发布关于公开征求《用于产生真实世界证据的真实世界数据指导原则(征求意见稿)》意见的通知。意见稿指出,真实世界数据的来源按功能类型主要可分为医院信息系统数据、医保支付数据、登记研究数据、药品安全性主动监测数据、自然人群队列数据、组学数据、死亡登记数据、患者报告结局数据、来自移动设备的个体健康监测数据、公共卫生监测数据、患者随访数据、患者用药数据等。
国际药讯
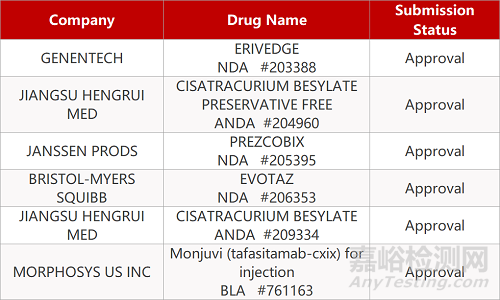
1.FDA加速批准“加强版”CD19单抗上市。FDA加速批准MorphoSys和Incyte联合开发的Monjuvi(tafasitamab-cxix)上市,与来那度胺(lenalidomide)联用,二线治疗成人复发/难治性弥漫性大B细胞淋巴瘤(DLBCL)患者,包括低级别淋巴瘤引起的DLBCL,以及不适合接受自体干细胞移植(ASCT)的患者。Monjuvi是一种通过改造抗体Fc端增强细胞介导的细胞毒性反应的人源化抗CD19单抗,在一项Ⅱ期临床L-MIND中,Monjuvi与来那度胺联用,在这类患者中达到55%的总缓解率,包括37%的完全缓解率和18%的部分缓解率。中位缓解持续时间为21.7个月。
2.诺华司库奇尤单抗欧盟获批一线治疗儿童银屑病。欧盟委员会批准诺华Cosentyx®(司库奇尤单抗,俗称苏金单抗)用于治疗6至18岁儿童和青少年的中重度斑块状银屑病。此次批准,是基于两项6岁至18岁儿童和青少年中开展的Ⅲ期研究结果。研究显示,低剂量(75-150mg)和高剂量(75-300mg)的Cosentyx在快速改善皮肤症状和生活质量方面均高度有效,长达52周的安全性良好。Cosentyx是全球首个IL-17A抑制剂,已获批银屑病关节炎,强直性脊柱炎等多项适应症。
3.武田NAE抑制剂获FDA突破性疗法认定。FDA授予武田“first-in-class”NEDD8激活酶(NAE)抑制剂pevonedistat突破性疗法认定,用于治疗高风险骨髓增生异常综合征(HR-MDS)患者。在一项Ⅱ期临床试验Pevonedistat-2001中,pevonedistat与阿扎胞苷联用使HR-MDS患者达到23.9个月的总生存期(OS),而阿扎胞苷单药疗法的OS仅为19.1个月。pevonedistat有望成为十多年来首个治疗HR-MDS患者的创新药物。目前,这些患者的治疗选择仅限于低甲基化药物(HMA),即使采用已有疗法,HR-MDS患者的预后仍然不良。
4.阿斯利康奥希替尼获FDA突破性疗法认定。7月30日,阿斯利康第三代EGFR抑制剂奥希替尼(osimertinib,Tagrisso)获FDA授予突破性疗法认定,作为辅助疗法,治疗接受治愈性切除手术的早期(IB、II和IIIA)表皮生长因子受体突变(EGFRm)非小细胞肺癌(NSCLC)患者。在一项Ⅲ期临床ADAURA中,奥希替尼作为辅助治疗将这类患者的疾病复发或死亡风险降低约80%。Tagrisso此前已在美国、日本等多个国家获批用于一线治疗局部晚期/转移性EGFRm NSCLC患者。
5.强生EGFR-MET双抗非小细胞肺癌III期临床启动。强生公司在ClinicalTrials.gov官网上登记启动了Amivantamab(EGFR-MET双抗)联合Lazertinib(三代EGFR-TKI)一线治疗EGFR突变(外显子19缺失或外显子21 L858R替换)的局部晚期或转移性非小细胞肺癌的III期临床研究(NCT04487080)。该研究拟入组1000患者评估Amivantamab+Lazertinib联合疗法较奥希替尼或单药一线治疗的安全与有效性。今年3月,Amivantamab已获FDA授予的突破性疗法称号,用于治疗铂类化疗后进展的EGFR外显子20插入突变的转移性非小细胞肺癌患者。
6.新型抗体Nirsevimab预防RSV感染IIb期结果公布。医学期刊《新英格兰医学杂志》发表了赛诺菲和阿斯利康联合开发的呼吸道合胞病毒(RSV)单抗药物Nirsevimab的IIb期研究成果。该研究评估Nirsevimab在健康早产婴儿群体中的安全性和有效性。研究结果显示,与安慰剂组相比,Nirsevimab治疗组中RSV引起的下呼吸道感染就诊率下降70.1%(95% CI: 52.3%-81.2%),住院率下降了78.4%(95% CI: 51.9%-90.3%),只需注射一次,Nirsevimab就可以在长达5个月的RSV流行季期间提供持续保护。而且两组的安全性相似,未观察到任何超敏反应。
医药热点
股市资讯
【复星医药】控股子公司沈阳红旗产品盐酸乙胺丁醇片收到《药品补充申请批准通知书》。
【智飞生物】(1)2020年半年度实现营业收入69.94亿元(38.8%),实现归母净利润15.05亿元(31.18%),实现扣非归母净利润15.13亿元(28.58%)。
【泰格医药】本次H 股发行价格为每股100.00港元,预计将于2020年8月7日开始在香港联交所主板上市交易。
审评动向
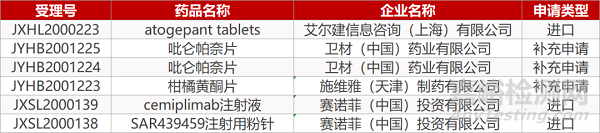
1. CDE最新受理情况(08月03日)
- The End -

来源:药研发


