您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-05-29 09:35
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
艾伯维/Ironwood利那洛肽缓释剂II期临床失败。艾伯维与Ironwood公司联合开发的利那洛肽缓释制剂MD-7246,在用于改善肠易激综合征伴腹泻(IBS-D)患者腹痛症状的II期临床NCT03931785中未达到主要终点和关键次要终点。388例患者随机接受不同剂量(300μg、600μg、1200μg)MD-7246或安慰剂治疗,主要疗效终点是每周最严重腹痛与基线相比的变化;以及总体腹痛反应,定义为在12周中至少有6周的腹痛比基线降低至少30%。结果显示,MD-7246并未使IBS-D腹痛明显改善。两家公司决定暂停这款非阿片类药物缓解剂的研发。
国内药讯
1.仟源医药依巴斯汀片首家通过一致性评价。仟源医药旗下杭州澳医保灵药业依巴斯汀片获国家药监局核发的药品补充申请批件,成为该品种首家通过一致性评价的产品。依巴斯汀片适用于伴有或不伴有过敏性结膜炎的过敏性鼻炎(季节性和常年性),以及慢性特发性荨麻疹的对症治疗。该品种目前国内共有3家生产企业获批,分别是西班牙艾美罗公司、联环药业和杭州澳医保灵药业。
国际药讯
1.BMS多发性硬化症新药Zeposia获欧盟批准。百时美施贵宝(BMS)宣布,欧盟委员会(EC)批准Zeposia(ozanimod)用于治疗由临床或影像学特征定义的活动性复发缓解型多发性硬化症(RRMS)成人患者。Zeposia是一款口服选择性鞘氨醇1-磷酸受体调节剂,已获FDA批准用于治疗成人复发型多发性硬化症,包括临床孤立综合征、复发缓解型多发性硬化症和活动性继发进展型多发性硬化症。FDA和EC的批准都是基于目前为止在MS患者中开展的最大规模、头对头关键Ⅲ期临床SUNBEAM和RADIANCE Part B的研究数据。
2.first in class抗体偶联药物对铂耐药卵巢癌疗效积极。Mersana Therapeutics公司靶向NaPi2b的抗体偶联药物XMT-1536,在针对卵巢癌、非小细胞肺腺癌的I期扩展研究中获积极中期数据。安全性与既往研究一致,未发现新的安全性信号。在20例可评估的铂耐药卵巢癌患者中,经确认的CR为10%(2/20),PR为25%,ORR达到35%。40%的患者疾病稳定,疾病控制率达到80%。观察到了生物标志物-疗效反应关系,支持在后续开发中采用基于NaPi2b生物标志物的患者筛选策略。截止数据读取时,7例NSCLC腺癌患者中有4例疗效可评估,2例患者疾病稳定。
3.葛兰素史克ADC组合疗法获积极临床数据。葛兰素史克靶向B细胞成熟抗原(BCMA)的抗体偶联药物(ADC)belantamab mafodotin,在临床试验DREAMM-2和DREAMM-6中,进一步证明了其治疗复发/难治性多发性骨髓瘤患者的潜力。其中,在评估belantamab mafodotin联合硼替佐米/地塞米松(BorDex)治疗既往接受一线治疗后病情仍进展或复发患者的DREAMM-6研究中,这一组合疗法的客观缓解率达到78%,其中50%达到非常好的部分缓解,28%达到部分缓解。目前,该疗法的生物制品许可申请正在接受FDA的审评。
4.默沙东联手Ridgebeck Bio开发创新抗病毒药物。默沙东(MSD)宣布与Ridgebeck Bio公司就Ridgebeck Bio的一款病毒广谱抑制剂EIDD-2801达成研发合作。EIDD-2801是一款口服RNA依赖性RNA聚合酶(RdRP)抑制剂,最初拟用于治疗流感。然而研究发现,它对包括新冠病毒在内的多种病毒具有“广谱“抑制活性,而且它能够对已经对瑞德西韦产生抗性的冠状病毒起作用。目前EIDD-2801已在人体试验中接受了安全性检验,Ⅱ期临床试验可能在本周开始。
5.吉利德与Arcus合作开发创新PD-1和TIGIT抑制剂。吉利德和Arcus Biosciences公司达成为期10年的合作协议,共同开发和商业化Arcus研发管线中的候选药物,其中包括创新PD-1抑制剂和免疫检查点蛋白TIGIT的抑制剂。目前,Arcus拥有4个免疫肿瘤学在研项目和6个肿瘤学临床前项目。其三款在研产品的组合(TIGIT抗体AB154、A2aR/A2bR拮抗剂AB928、以及PD-1抗体zimberelimab)一线治疗非小细胞肺癌处于Ⅱ期临床阶段。根据协议,Arcus将获3.75亿美元的付款以及可能高达12.25亿美元的潜在里程碑付款。吉利德将获Arcus目前和未来的免疫肿瘤学产品。
医药热点
1.日本研发出泪水检测乳腺癌新技术。据外媒报道,日本神户大学成功研发出了使用泪水进行乳腺癌检测的新技术。这一技术名为“TearExo”,使用一种内置金属片的特制滴管采集泪水,然后使用精密仪器对泪水进行检测,只需10分钟至20分钟就能测出其中是否含有癌细胞,还可以检测出正在接受治疗患者使用的药物是否生效。该检测设备计划从2021年开始正式投入使用。
2.北京大学新设应急管理二级学科。北京大学发布消息,该校在其公共管理一级学科下设置应急管理二级学科,下设五个研究方向,从今年开始招收硕博研究生。这五个研究方向分别为:应急管理理论与方法、应急管理体系与能力、风险管控与应急管理、智能化应急管理、比较应急管理。目前,北京大学正在加速推进在公共卫生与预防医学学科下设置应急管理相关学科的论证工作。
3.法国宣布禁用羟氯喹治疗新冠。当地时间26日,法国政府宣布禁止使用羟氯喹治疗新冠病毒。这也是世卫组织宣布暂停羟氯喹治疗新冠试验后,首个禁用羟氯喹治疗新冠的国家。25日,世界卫生组织宣布暂停“团结试验”项目中羟氯喹分支试验。原因是近期英国《柳叶刀》杂志发表的观察报告显示,抗疟疾药物氯喹或羟氯喹对治疗新冠病毒感染没有明显益处,使用不当甚至可能引发并发症。
股市资讯
【恒瑞医药】子公司成都盛迪医药有限公司的他氟前列素滴眼液近日被国家药品监督管理局药品审评中心纳入拟优先审评品种公示名单
【海辰药业】全资子公司安徽海辰于近日参与了肥东县FDG20-10地块土地使用权的竞拍,并最终以人民币2,580万元竞得该宗土地的使用权
【鲁抗医药】收到国家药品监督管理局颁发的关于阿莫西林颗粒的《药品补充申请批件》,该药品通过仿制药质量和疗效一致性评价
审评动向
1. CDE最新受理情况(05月28日)
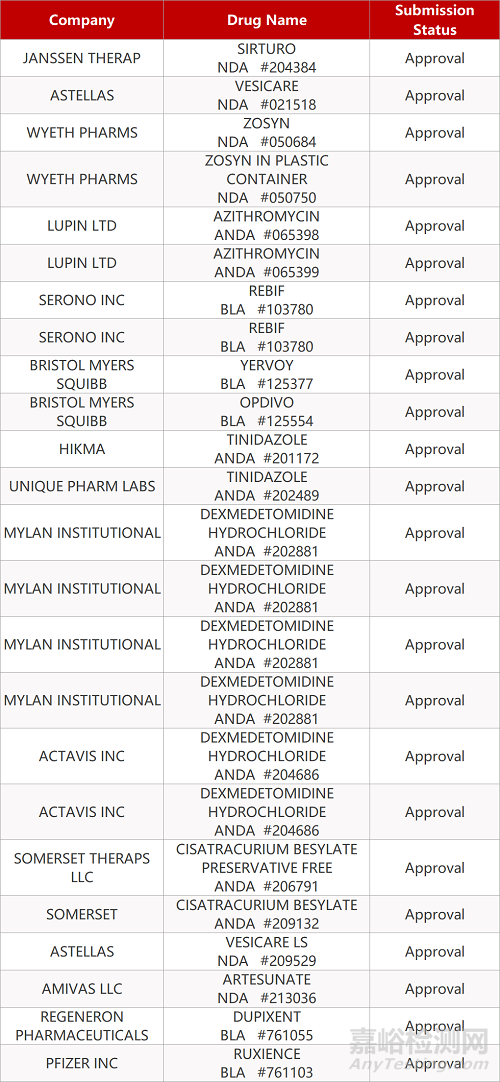
2. FDA最新获批情况(北美05月27日)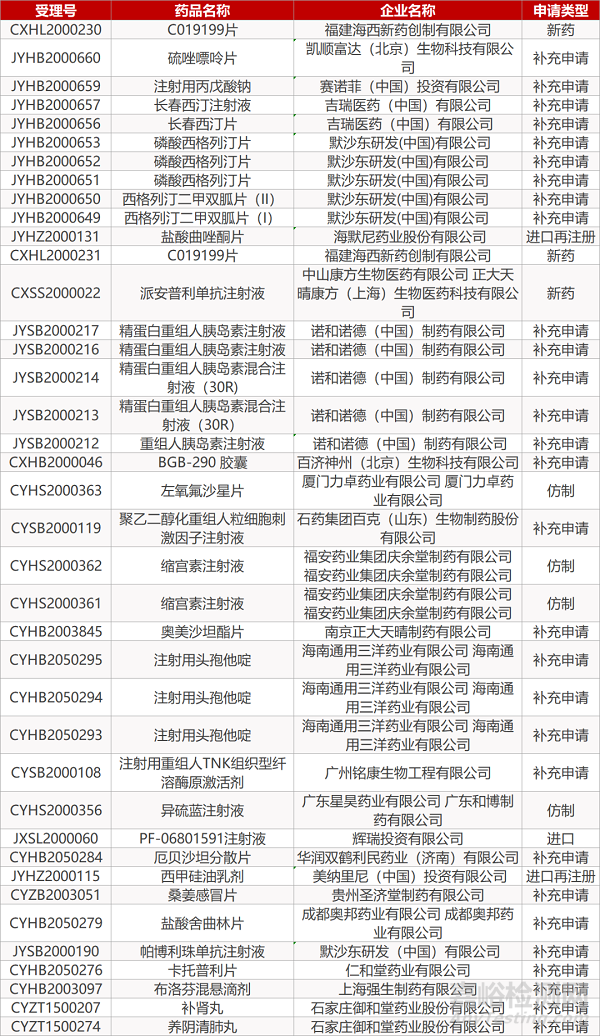
- The End -

来源:药研发


