您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-04-21 09:35
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「本文共:16条资讯,阅读时长约:3分钟 」
百济神州泽布替尼COVID-19项目在美国启动。据福布斯报道,百济神州正在美国开展一项布鲁顿氏酪氨酸激酶(BTK)抑制剂泽布替尼在重症新冠肺炎(COVID-19)患者中的临床试验。据悉,百济神州已向FDA提交了一项II期随机试验申请,拟招募42例应需要氧疗的美国患者(其中6例患者将接受机械通气),预计在两至三个月内取得结果。2019年11月,泽布替尼已获FDA加速批准用于二线治疗既往接受过至少一项疗法的成年套细胞淋巴瘤(MCL)患者,是首个在美国获批的国产抗癌新药。
1.复星新冠病毒核酸检测试剂盒获FDA紧急使用授权。复星医药旗下复星长征自主研发的新冠病毒2019-nCov核酸检测试剂盒(荧光PCR法)获FDA紧急使用授权。该款试剂盒对新型冠状病毒ORF1ab、N、E三个基因靶标的定性检测,具备全自动操作的优势,通过配套快速核酸提取仪及提取试剂,于2小时内完成96个样本的全部检测。目前该试剂盒也取得国家药监局颁发的医疗器械注册证,以及欧盟CE认证。
2.齐鲁制药依西美坦片获FDA批准。齐鲁制药乳腺癌治疗药物依西美坦片获FDA批准上市。依西美坦片原研厂家为辉瑞,于1999年获FDA批准上市,临床适用于经他莫昔芬辅助治疗2-3年后,绝经后雌激素受体阳性妇女的早期浸润性乳腺癌的辅助治疗,直至完成总共5年的辅助内分泌治疗;以及用于经他莫昔芬治疗后,其病情仍有进展的自然或人工绝经后妇女的晚期乳腺癌。该原研药2008年已获批进入中国。在中国,齐鲁制药是该品种国内首家也是唯一一家提交一致性评价申请的企业。
3.硕世生物新冠病毒核酸检测试剂盒获批。4月19日,硕世生物发布公告称,该公司新型冠状病毒2019-nCoV核酸检测试剂盒(荧光PCR法)已获国家药监局批准(注册证号:国械注准20203400384)。该试剂盒用于体外定性检测新冠病毒感染的肺炎疑似病例、疑似聚集性病例患者、其他需要进行新冠病毒感染诊断或鉴别诊断者的咽拭子、鼻咽拭子、痰液样本中,新冠病毒(2019-nCoV)ORF1ab和N基因。据悉,国内已有30个产品取得同类产品的医疗器械注册证书。
4.索凡替尼获FDA授予2项快速通道资格。和黄医药酪氨酸激酶抑制剂索凡替尼(surufatinib)获FDA授予2项快速通道资格,用于治疗不适合手术的晚期和进行性胰腺神经内分泌肿瘤(NET)和非胰腺NET患者。该药此前已获FDA授予用于治疗NET的孤儿药资格。索凡替尼具有抗肿瘤血管生成和免疫调节的双重机制,它可能非常适合与其他免疫疗法联合使用。目前和黄医药正在中国及美国开展索凡替尼单药或与其他免疫疗法联合治疗的多项研究,涉及的适应症包括神经内分泌瘤、非胰腺神经内分泌瘤、胰腺神经内分泌瘤以及胆道癌。
5.安斯泰来吉瑞替尼拟纳入优先审评。4月17日,安斯泰来在中国提交的富马酸吉瑞替尼片上市申请获CDE纳入拟优先审评公示名单。吉瑞替尼是安斯泰来与Kotobuki制药合作开发的一种FMS样酪氨酸激酶3(FLT3)抑制剂,于2018年相继在日本和美国获批上市用于治疗复发性或难治性FLT3突变急性髓系白血病成年患者,是FDA批准的首个用于复发性难治性急性粒细胞白血病的FLT3抑制剂。
6.迈博斯抗体新药TST001在美获批临床。迈博斯生物开发的Claudin18.2(CLDN18.2)人源化单克隆抗体(TST001)新药获FDA药物临床试验批件。TST001是一种人源化的高亲和力抗CLDN18.2抗体,可通过抗体依赖性细胞毒性(ADCC)杀死肿瘤细胞。在临床前研究中,TST001在多种肿瘤动物模型中显示有效,并且在GLP毒理学研究中具有良好的耐受性。此外,TST001在中国也已获NMPA批准开展用于治疗转移性实体瘤的临床试验。
1.FDA批准首个检测冠状病毒的抗体测试。生物技术公司Cellex开发的抗体测试获FDA紧急使用授权。这是FDA批准的首个检测冠状病毒抗体的测试。广泛的抗体测试可以用来确定在人群中有多少人感染了病毒并可能有了免疫力。据悉,该抗体测试需要在授权实验室进行,检测过程大约需要15到20分钟。该测试寻找两种抗体:免疫球蛋白M和免疫球蛋白G。
2.T1D预防性抗体药物teplizumab在美申报上市。Provention Bio宣布向FDA滚动提交其抗CD3单抗teplizumab(PRV-301)的生物制品许可申请,用于高危人群预防或延缓发生临床1型糖尿病(T1D),这里的高危人群是指体内存在2种或多种与T1D相关的自身抗体。在一项At-Risk研究中,teplizumab治疗显著推迟了高危儿童和成人临床T1D的发病和诊断时间,T1D发病率降低50%,发病中位时间推迟至少2年。在美国和欧盟,teplizumab分别被授予突破性药物资格和优先药物资格。如果获批,teplizumab将成为首款可预防/延缓高危人群发展为T1D的疗法。
3.礼来推出低价版胰岛素。礼来制药宣布在美国市场正式推出两款预充式胰岛素注射产品——Humalog®Mix75/25™ KwikPen®和Humalog® Junior KwikPen® 的低价版产品。这两款低价版的胰岛素注射剂与相同规格的品牌产品所含成分完全相同,只是采用了不同的包装,价格降低了50%,而且二者的总处方量占礼来就餐胰岛素产品线处方量的90%以上。一份胰岛素成本分析报告显示,胰岛素价格在2012年至2016年间翻了一番。导致即使购买医保的患者,也难以保证能顺利地购买和使用胰岛素。监管机构此前曾就胰岛素价格问题成立专项调查。
4.全球3月份临床研究入组患者数下降65%。Medidata的一项报告显示,受到COVID-19全球大流行的影响,3月份的临床试验入组数出现大幅下滑。和2019年3月份相比,全球临床试验入组患者数量同比下降65%。其中内分泌类药物临床受到的影响最大,入组患者数同比下降80%,其次为心血管、中枢神经系统和皮肤病类的疾病,入组患者数同比下降超60%。呼吸系统领域的临床试验入组患者数下降最少,仅为33%。报告显示,就临床研究入组数量来说,受COVID-19影响最大的国家为英国,临床试验入组患者数量同比下降80%。
5.猕猴或可作为新冠病毒感染的一种研究模型。荷兰科学家在《科学》发表的一篇最新研究论文表明,食蟹猕猴(一种猕猴)在感染新冠病毒后,会出现类似于人类COVID-19的轻症,并且会在无症状感染的情况下排出病毒,可以作为研究新冠病毒感染的一种新模型。与过去感染SARS病毒的食蟹猕猴模型相比,研究人员指出,新冠病毒会造成弥漫性肺泡损伤,比SARS导致的肺部损伤要轻得多,但呼吸道排出新冠病毒的时间要早得多——在感染早期,病毒排出即达到高峰。而这些重要特征正是COVID-19在人群中比SARS检测更有难度、传播更迅速的重要因素。
6.Alnylam拟加速开发RNAi疗法。Alnylam公司与黑石生命科学(Blackstone Life Sciences)达成一项战略合作协议。根据协议,Alnylam公司将获得黑石提供的高达20亿美元的资金来支持其RNAi疗法vutrisiran和ALN-AGT等在研疗法的临床开发。而黑石将获得Alnylam公司合作开发的RNAi疗法inclisiran未来销售额分成的50%。Inclisiran是一款靶向PCSK9的RNAi疗法,目前正在接FDA的审评,如果获批,将有望帮助高胆固醇血症患者降低其低密度脂蛋白胆固醇水平。
1.巴黎非饮用自来水中检测到新冠病毒。当地时间19日,巴黎市政部门宣布在城市的非饮用水系统中测出新冠病毒。巴黎市政部门管理的实验室在测试的27个采样点中的4个中发现了“微量”病毒,巴黎市政府随即暂停使用非饮用水系统,卫生部门将进一步分析这些微量病毒可能存在的风险。截至当地时间19日,法国新冠肺炎累计死亡病例增至19718例。目前法国仍在住院的新冠肺炎患者为30610人,住院人数和重症患者人数继续缓慢下降。法国卫生总署署长呼吁民众不要放松戒备。
2.华盛顿州紧急召回12000份新冠病毒检测试剂。据美国有线电视新闻网4月19日报道,美国华盛顿州当天宣布,由于怀疑受到污染,该州已经紧急召回12000份新冠病毒检测试剂。4月17日,华盛顿大学医学部通知该州卫生部门,称发现少量病毒运输液出现颜色异常,可能导致质量控制问题。该州呼吁已经收到试剂的用户联系卫生部门以更换新的试剂。
3.三级综合医院应具备独立开展新冠病毒检测能力。国务院应对新冠肺炎疫情联防联控机制综合组印发《关于进一步做好疫情期间新冠病毒检测有关工作的通知》。《通知》从加强实验室建设、依法依规开展检测、保障检测结果准确可靠、加强检测质量控制和加强实验室生物安全管理等5个方面对各地提升新冠病毒实验室检测能力提出要求。通知明确指出,三级综合医院均应当建立符合生物安全二级及以上标准的临床检验实验室,具备独立开展新型冠状病毒检测的能力。
【新光药业】1)2019年度实现营业收入2.91亿元(+5.43%);归母净利润0.94亿元(+6.71%);扣非归母净利润0.90亿元(+11.10%)。2)Wind一致增速-年报-Q4增速为6.71%-6.71%- 13.28%,扣非为6.71%- 11.10%- 29.44%。3)公司计划于5月15日召开股东大会。
【康缘药业】公司收到国家药品监督管理局签发的关于新药“筋骨止痛凝胶”的《药品注册批件》。
【博雅生物】公司审议通过《关于终止发行股份、可转换公司债券购买资产的议案》,决定终止发行股份、可转换公司债券购买无锡罗益生物制药有限公司48.87%股权事项。
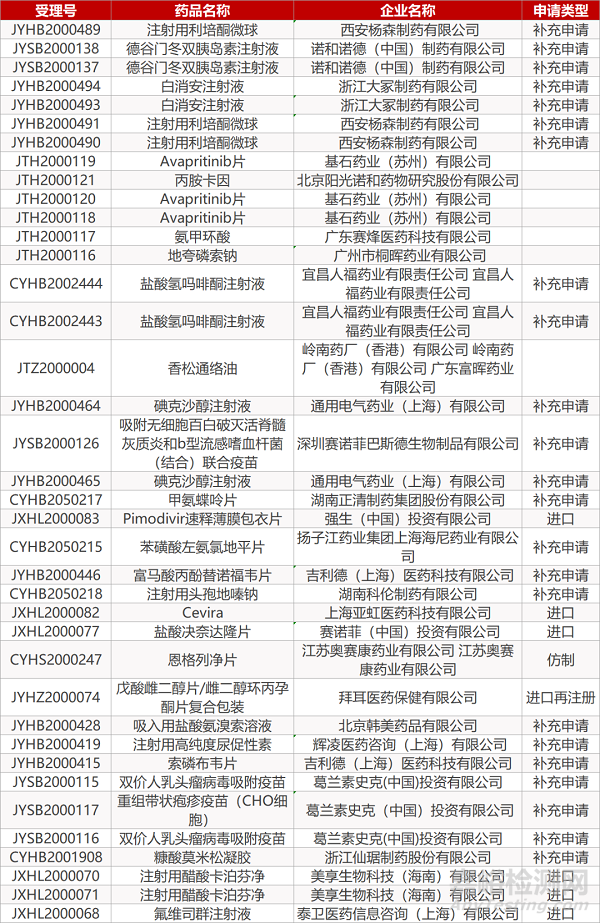
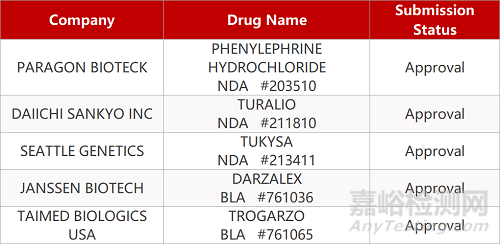
1. CDE最新受理情况(4月20日)
- The End -

来源:药研发


