您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2019-12-23 09:09
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「本文共:16条资讯,阅读时长约:3分钟 」
今日头条
上海发文鼓励医疗机构参与临床研究。为完善上海市的临床研究体系,支持生物医药产业高质量发展,上海市卫健委会同相关部门共同制定了《关于加强本市医疗卫生机构临床研究支持生物医药产业发展的实施方案》。《方案》以坚持需求导向、联动发展、创新驱动与群众受益为工作原则,设定了推进研究型医院建设、促进临床研究资源共享与合作、鼓励医疗卫生机构与医务人员参与临床研究、加快临床研究重点领域突破以及推进生物治疗技术和重大创新产品临床应用等五项任务。
国内药讯
1.豪森药业卡格列净获批上市。豪森药业卡格列净片获国家药监局批准上市,成为首个国产SGLT-2抑制剂,用于2型糖尿病患者。此次获批也标志着豪森药业成功实现糖尿病领域GLP-1、DPP-4、SGLT-2等全球热门产品全覆盖。卡格列净最早由田边三菱研制开发,2013年3月获FDA批准上市,是FDA 批准的首款SGLT-2抑制剂。目前共有8种SGLT-2抑制剂上市,全球共有 20 个品种获批。此前我国已批准进口3个SGLT-2抑制剂药物(单方),分别是BMS的达格列净 (安达唐)、勃林格殷格翰的恩格列净 (欧唐静)、西安杨森的卡格列净 (怡可安)。
2.石药玄宁首获美国FDA完全批准上市。石药马来酸左旋氨氯地平片(CONJUPRI,玄宁)获FDA完全批准上市,用于治疗高血压。据悉,玄宁是我国首获FDA完全批准上市的新药。左旋氨氯地平为用于治疗高血压的纯化(S)-氨氯地平。氨氯地平是辉瑞于1992年开发的第三代钙通道阻滞剂。玄宁最早于2003年在我国获批上市。一项真实世界的数据研究(LEADER研究)结果显示,马来酸左旋氨氯地平一半剂量的降压疗效与苯磺酸氨氯地平相当;在不良反应方面,马来酸左旋氨氯地平明显优于苯磺酸氨氯地平(进口),尤其是水肿及头痛方面表现更加突出。
3.诺华双靶向联合疗法在华获批。诺华达拉非尼(泰菲乐)和曲美替尼(迈吉宁)双靶向联合治疗药物获国家药监局批准,适用于治疗BRAF V600突变阳性不可切除或转移性黑色素瘤。诺华也于年初递交了泰菲乐和迈吉宁联合疗法用于BRAF V600突变阳性的3期黑色素瘤完全切除术后辅助治疗的申请。泰菲乐是一种选择性BRAF激酶活性抑制剂,迈吉宁是一种可逆的、高选择性MEK1/MEK2激酶活性的变构抑制剂。多项临床研究结果显示,与靶向单药相比,泰菲乐联合迈吉宁可帮助BRAF V600突变黑色素瘤患者得到更高的疾病缓解,实现更长的无进展生存。
4.中国境内首个法布雷病药物获批。赛诺菲子公司Genzyme的阿加糖酶β(Fabrazyme)获国家药监局批准上市。阿加糖酶β是一款酶替代疗法,于2003年在美国获批上市,用于治疗一种罕见遗传病——法布雷病(α-半乳糖苷酶A缺乏)。阿加糖酶β也是中国获批的首个用于治疗法布雷病的药物,适用于8岁以上的儿童和青少年及成人,该药此前已被列入国家第二批临床急需新药名单。法布雷病是由X连锁基因缺陷造成的一种先天性代谢疾病,该病始发于胎儿并伴随患者终身逐步恶化,引起心、肾等重要器官的衰竭。
5.赛隆药业3项注射剂审评新进展。赛隆药业3款注射剂的上市申请审评状态有了新进展:阿加曲班注射液、注射用胸腺法新的仿制申请处于“审批完毕-待制证”状态;注射用替加环素的仿制申请处于“制证完毕-待发批件”状态。阿加曲班是全球首个小分子直接凝血酶抑制剂,该药原研药由三菱制药开发,用于抗血栓形成。胸腺法新是一种分离自胸腺素的小分子氨基酸活性短肽,主要用于慢性乙型病毒性肝炎和恶性肿瘤的辅助治疗,该药原研药由赛生药业开发。替加环素为甘氨酰环类抗菌药,该药原研药由辉瑞惠氏开发。
6.应世生物FAK抑制剂在中国获批临床。应世生物创新抗癌药IN10018片获国家药监局临床试验默示许可,适应症为局部晚期或转移性胃或胃食管交界处腺癌。IN10018是勃林格殷格翰开发的一款FAK抑制剂,应世生物拥有该药的全球开发和商业化权利。今年8月该药刚在美国获得临床试验许可。目前,应世生物IN10018与罗氏旗下的小分子MEK抑制剂cobimetinib已达成临床试验合作,拟在葡萄膜黑色素瘤癌症患者中评估联合用药的安全性、耐受性、以及抗肿瘤疗效。
国际药讯
1.FDA加速批准阿斯利康/第一三共创新ADC。第一三共制药与阿斯利康公司联合开发的靶向HER2的抗体偶联药物(ADC)Enhertu(fam-trastuzumab deruxtecan-nxki,DS-8201)获FDA批准上市,治疗无法切除或转移性HER2阳性乳腺癌患者。一项关键性Ⅱ期临床数据显示,在治疗平均接受过6种前期疗法(包括ado-trastuzumab emtansine,trastuzumab,pertuzumab等)的HER2阳性乳腺癌患者中,Enhertu达到60.9%的客观缓解率和97.3%的疾病控制率。患者的中位缓解时间为14.8个月,中位无进展生存期为16.4个月。而且,Enhertu在治疗HER2低表达乳腺癌和表达HER2的胃癌和其它癌症类型中也表现出良好的疗效。
2.FDA批准首个埃博拉病毒疫苗上市。默沙东开发的减毒活疫苗Ervebo疫苗获FDA批准上市,用于18岁以上成人预防由于扎伊尔埃博拉病毒(Zaire ebolavirus)感染导致的埃博拉病毒病(EVD)。今年11月,Ervebo已获欧盟有条件批准上市。在2014-2016年在几内亚EVD爆发时开展的一项研究中,3537例埃博拉病毒暴露人员和接触经实验室确诊EVD的暴露人员(18岁以上)接受“立即”或21天“延迟”接种Ervebo,结果显示,“即时”接种组中未观察到EVD症状发作病例,接种后10天(含)以上没有出现埃博拉病例记录,100%有效;“延迟”组中观察到10例(n=1429)EVD病例。
3.吉利德递交JAK1抑制剂新药申请。吉利德拟用于治疗中重度类风湿关节炎(RA)成人患者的JAK1抑制剂filgotinib已向FDA递交了新药申请,吉利德为其使用了优先审评券。一项Ⅲ期临床FINCH 1结果显示,与安慰剂+MTX相比,filgotinib联合MTX可显著提高之前已接受MTX治疗但反应不佳的RA患者达到ACR20(美国风湿病学会疗法评估指标之一)的患者比例。在filgotinib单药或与MTX联用治疗未接受过MTX治疗的RA的FINCH 3临床中,与MTX相比,filgotinib联合MTX可显著提高患者达到ACR20的比例。组合疗法还达到多项关键性次级终点。
4.Epizyme递交EZH2抑制剂新药申请。Epizyme公司已向FDA递交其“first-in-class“EZH2抑制剂tazemetostat的新药申请,寻求加速批准这一创新疗法治疗复发或难治性滤泡性淋巴瘤(FL)患者。在一项Ⅱ期临床中,携带野生型EZH2基因或突变型EZH2基因的FL患者接受tazemetostat的单药治疗。试验结果表明,tazemetostat治疗携带EZH2突变的患者时达到69%的客观缓解率(ORR),治疗野生型EZH2患者时这一数值为35%。突变型EZH2患者的中位无进展生存期(PFS)为14个月,野生型EZH2患者的PFS为11个月。这两个患者群的中位OS均尚未达到。该新药刚刚获FDA肿瘤学药物咨询委员推荐,治疗转移性/局部晚期上皮样肉瘤患者。
5.膀胱癌突破性疗法获优先审评资格。UroGen 公司宣布,FDA已接受其凝胶药物UGN-101的新药申请(NDA),用于治疗低级别上尿路上皮癌(LG UTUC)患者。FDA同时授予该药物优先审评资格,预计将在明年4月18日作出回复。一项关键性Ⅲ期临床OLYMPUS结果显示,在总意向治疗患者组中,UGN-101达到完全缓解(CR)的患者比例为59%。有89%的患者的缓解持续时间(DOR)达到6个月,84%的患者DOR达到12个月。患者的中位复发时间为13个月。在无法通过手术切除肿瘤的患者亚组中,患者CR与DOR达到12个月的比例与总意向治疗患者组的结果相同。
6.Jazz公司与PharmaMar公司达成合作。PharmaMar和Jazz Pharmaceuticals公司就PharmaMar公司拟用于治疗晚期小细胞肺癌(SCLC)的合成化合物lurbinectedin达成一项独家许可协议。根据协议,Jazz将获得lurbinectedin的开发和推广权益。lurbinectedin刚刚向FDA提交了新药申请。PharmaMar将获2亿美金的预付款。若FDA加速批准和/或完全批准lurbinectedin的新药申请,PharmaMar还可能获得高达8亿美元的潜在里程碑付款,以及在未来的销售额分成。如果批准lurbinectedin的其它适应症,PharmaMar还将有可能获得额外的款项。
医药热点
1.医院及医学院校科技量值发布。《2018年度中国医院科技量值报告》与《2018年度中国医学院校科技量值报告》发布。《2018年度中国医院科技量值报告》覆盖全国1660家医院,此次发布综合和29个学科前100位医院排名。综合排名前10位的医院分别是:四川大学华西医院、中国人民解放军总医院、中国医学科学院北京协和医院、浙江大学医学院附属第一医院、上海交通大学医学院附属瑞金医院、复旦大学附属中山医院、华中科技大学同济医学院附属同济医院、北京大学人民医院、南京医科大学第一附属医院、北京大学第三医院。
2.全国统一跨省异地就医备案服务试点启动。国家医保局推出国家异地就医备案小程序(试运行),正式启动全国统一跨省异地就医备案服务试点工作。国家异地就医备案小程序以跨省异地就医备案为核心功能,拓展跨省异地就医联网定点医疗机构、开通统筹地区和医保经办机构相关信息查询和地方医保信息系统停机公告等服务。首次试点地区为内蒙古自治区区本级、辽宁省省本级等14个统筹地区。
3.北京东直门医院通州院区可刷脸挂号缴费。目前,北京东直门医院通州院区有17台自助服务一体机增设了人脸识别支付系统,患者通过“刷脸”,30秒内即可完成支付。据介绍,在首次设置时,当患者选择人脸识别支付模式,AI智能摄像头就会自动打开,通过“扫脸”,提示患者输入身份证号、手机号等信息,并与支付宝账号完成绑定;之后系统会进行第二次识别并储存记忆。设置完成后,患者再来医院就诊,只需在自助服务一体机前“刷脸”,再输入手机号,即可完成挂号、缴费、打印化验单等操作。
股市资讯
【中国医药】全资子公司海南通用三洋药业有限公司的注射用盐酸头孢替安药品注册申请已处于“审批完毕-待制证”状态 。
【科伦药业】公司配股申请获得中国证监会批准,核准公司向原股东配售2亿股新股。
【珍宝岛】(1)2019年度审计机构更换为中审众环会计师事务所。(2)董事长、总经理方同华辞去总经理职务,聘任陈海担任公司总经理。
审评动向
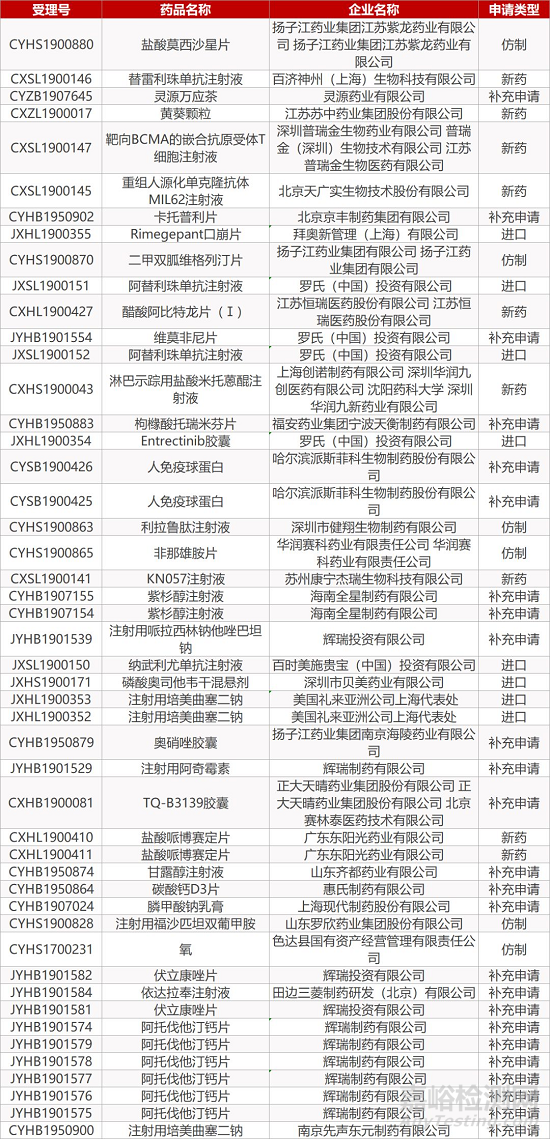
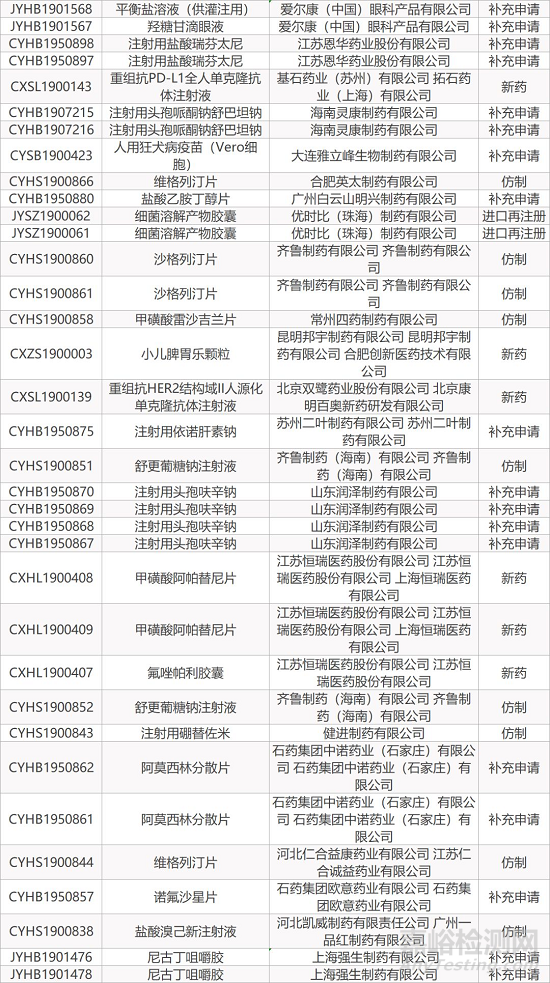
1. CDE最新受理情况(12月22日)
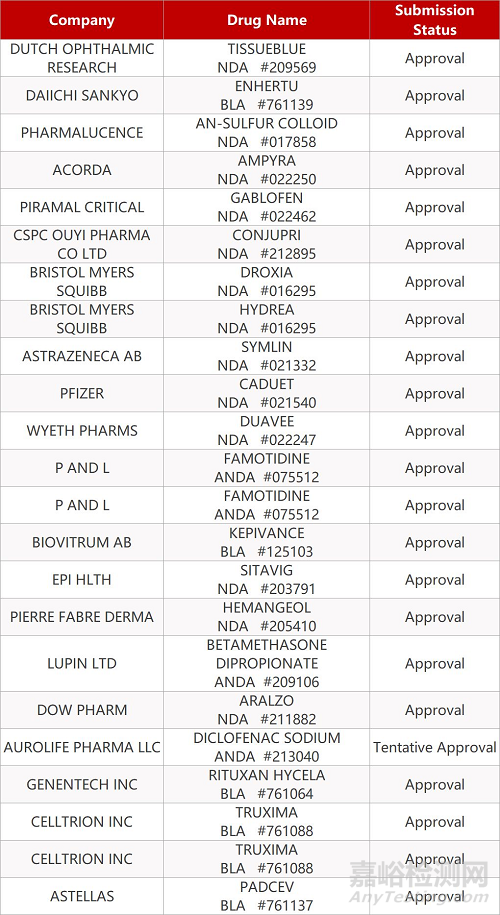
2. FDA最新获批情况(北美12月121日)

来源:药研发


