您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2019-10-09 09:00
「本文共:15条资讯,阅读时长约:3分钟 」
今日头条
国内药讯
1.双成药业普瑞巴林胶囊获FDA批准上市。双成药业仿制药普瑞巴林胶囊获FDA批准上市。普瑞巴林是神经递质γ-氨基丁酸的衍生物,具有镇痛和抗惊厥的作用。该药适用于糖尿病外周神经痛、带状疱疹后遗神经痛、成人部分性癫痫的辅助治疗及脊髓损伤相关的神经痛。该药原研药由辉瑞研发,于2004年12月获FDA上市批准,商品名为Lyrica,目前该原研药已在中国获批上市。双成药业计划即将启动普瑞巴林胶囊在中国的上市申请。
2.普利制药左乙拉西坦注射液在英国获批上市。普利制药左乙拉西坦注射液获英国药品和健康产品管理局(MHRA)批准上市。左乙拉西坦注射液是抗癫痫药物,用于患者以下症状发作时的辅助治疗:1月及以上儿童或成人癫痫患者的部分性癫痫发作的加用治疗;12岁及以上青少年或成人癫痫患者的肌阵挛性癫痫发作的加用治疗;6岁及以上儿童或成人患有特发性全身性癫痫发作的原发性强直阵挛发作的加用治疗。目前该药已在德国、荷兰和美国获批上市,该药的中国上市申请也拟纳入优先审评公示名单。
3.华润双鹤左乙拉西坦片通过一致性评价。华润双鹤子公司赛科药业的新4类仿制药左乙拉西坦片 (0.5 g)获国家药监局批准,用于治疗成人及 4 岁以上儿童癫痫患者部分性发作 (伴或不伴继发性全面性发作) 以及用于成人及 16 岁以上青少年癫痫患者全面性强直阵挛发作的加用治疗。该药原研药由优时比开发,1999年在美国获批上市,商品名开浦兰 (Keppra®),目前该原研药已获批进口中国。2018年左乙拉西坦的国内样本医院销售额约为3.55亿元人民币。除赛科药业外,该品种通过一致性评价的厂家还有京新药业和普洛康裕制药。
4.信立泰注射用特立帕肽获批上市。信立泰子公司苏州金盟注射用特立帕肽的上市申请审评状态更新为“审批完毕—待制证”。特立帕肽(重组人甲状旁腺素 1-34冻干粉针)是礼来开发的骨质疏松治疗领域的重磅药物,2002年在美国上市,商品名复泰奥,2011年获批进口中国,是目前唯一获FDA批准的能促进骨形成的药物,2018年该药全球销售额超过16亿美元。Insight数据库显示,2018年该品种国内销售额约3843万元。苏州金盟有望成为继上海联合赛尔生物后第二家获批的企业。
5.阿诺医药AN0025治疗直肠癌的Ⅰb期数据积极。阿诺医药在2019 ESMO上公布其口服E型前列腺受体4拮抗剂AN0025治疗局部晚期直肠癌的Ⅰb期临床数据。在两个剂量AN0025(250mmg 、500mmg )联合标准疗法治疗组中,所有患者均未观察到剂量限制性毒性(DLT)。在25例可评估患者中,有5例达完全缓解(cCR);有15例达到手术治疗条件,其中12例病人成功完成切缘清晰的根治性切除,对术后组织切片进行活检中,有4例病人切片中未见肿瘤,达到病理完全缓解(pCR)。此外,AN0025与放化疗、以及放疗后巩固化疗联合治疗的耐受性良好,AN0025具初步疗效。
国际药讯
1.罗氏美罗华获FDA批准首个儿科适应症。罗氏旗下基因泰克公司的靶向抗炎药Rituxan(美罗华,rituximab)获FDA批准,与糖皮质激素(GCC)联用治疗2岁及以上儿童的伴肉芽肿性多血管炎(GPA)和显微镜下多血管炎(MPA)。Rituxan也是首个获FDA批准治疗GPA和MPA的儿科药物。一项IIa期PePRS研究数据显示,Rituxan联合GCC治疗组有56%的患者在治疗第6个月达到儿童血管炎活动评分(PVAS)缓解,92%的患者在治疗第12个月达PVAS缓解,100%的患者在第18个月达PVAS缓解;Rituxan在儿童GPA和MPA患者中的安全性与之前研究一致。Rituxan此前已获批治疗成人的类风湿性关节炎、GPA、MPA等4种自身免疫性疾病。
2.强生卡格列净新适应症获FDA批准。强生旗下杨森降糖药Invokana(canagliflozin,卡格列净)新适应症获FDA批准,用于患有2型糖尿病和糖尿病肾病并且尿液中存在一定数量蛋白质的成人患者降低终末期肾病(ESKD)、肾功能恶化、心血管(CV)死亡、心衰住院的风险。一项III期研究CREDENCE的中期数据显示,与安慰剂+标准护理相比,Invokana 100mg+标准护理将主要复合终点(ESKD、血清肌酐增加一倍、肾脏或CV死亡)的风险降低30%;降低次要CV终点的风险,包括心衰住院风险降低39%;两组不良事件和严重不良事件发生率相似;没有新的安全信号被识别。
3.Galderma粉刺创新疗法Aklief软膏获FDA批准。高德美(Galderma)公司开发的视黄酸受体γ激动剂Aklief(trifarotene)软膏获FDA批准用于治疗9岁及以上寻常痤疮患者。此次批准是基于两项为期12周的Ⅲ期关键性临床结果。试验的主要终点为,治疗第12周时患者较基线时达到研究者总体评估总分(IGA)2分以上改善的成功率,面部炎症的改善以及非炎症病变计数的减少。试验结果显示,Aklief软膏可在两周内显著减少患者的炎症性病变。详细结果已发表在Journal of the American Academy of Dermatology期刊上。
4.NGM非酒精性脂肪肝新药达Ⅱ期临床终点。NGM Biopharmaceuticals公司拟用于治疗非酒精性脂肪性肝炎(NASH)的在研药物aldafermin(NGM282),在Ⅱ期试验第四队列的中期分析中达主要终点。该研究在伴有中重度(F2-F3)肝纤维化的已确诊NASH患者中评估aldafermin的疗效与安全性,中期分析数据显示,aldafermin治疗组72%的患者绝对肝脏脂肪(LFC)水平降低了至少5%,而安慰剂组只有17%的患者达到这一水平;24周后,aldafermin组有28%的患者LFC水平恢复正常,而安慰剂组没有观察到这一结果。此外,患者血清中与NASH有关的生物标志物ALT、AST以及患者肝纤维化标志物PRO-C3等都显示出临床意义的显著改善。
5.杨森Zejula获FDA突破性药物资格。杨森PARP抑制剂类抗癌药Zejula(则乐,niraparib,尼拉帕利)获FDA授予突破性药物资格,用于治疗先前已接受紫杉烷化疗和雄激素受体(AR)靶向药物治疗、携带BRCA1/2基因突变的转移性去势抵抗性前列腺癌患者。一项II期GALAHAD研究结果显示:在BRCA患者中,ORR为41%、CRR为63%、客观缓解中位持续时间为5.5个月(3.5-9.2),中位rPFS为8.2个月、中位OS为12.6个月;在非BRCA患者中,22例患者中有2例观察到客观缓解、CRR为17%、客观缓解持续时间为3.8个月和6.5个月;治疗引起的3/4级不良事件主要为贫血等,这些事件通过剂量中断或调整进行了管理。
6.辉瑞15亿美元囊获靶向RNA疗法。Ionis Pharmaceuticals旗下子公司Akcea 与辉瑞公司就其在研反义寡核苷酸药物AKCEA-ANGPTL3-LRx达成一项全球独家专利许可协议。AKCEA-ANGPTL3-LRx目前正在治疗2型糖尿病、高甘油三酯血症和非酒精性脂肪肝疾病患者的Ⅱ期研究中接受评估。一项Ⅰ/Ⅱ期试验结果显示,AKCEA-ANGPTL3-LRx能降低患者血浆中血管生成素样蛋白3水平达83%,显著降低甘油三酯(-66%),apoC-III(-68%),低密度脂蛋白胆固醇(-35%)、总胆固醇(-36%),HDL-C(-25%)和非HDL-C(-40%);且AKCEA-ANGPTL3-LRx具良好的耐受性和安全性。依据协议,Akcea将获2.5亿美元的预付款,并有权获得最高可达13亿美元的研发、监管、销售里程碑付款。辉瑞将负责继续开发AKCEA-ANGPTL3-LRx。
医药热点
1.2019年诺贝尔生理学或医学奖正式揭晓。2019年诺贝尔生理学或医学奖揭晓获奖名单,哈佛医学院Dana-Farber癌症研究所的William G. Kaelin、英国牛津大学弗朗西斯·克里克研究所的Peter J. Ratcliffe以及约翰霍普金斯医学院的Gregg Semenza共同获得该奖项。生物体感受氧气浓度的信号识别系统是生命最基本的功能。三位科学家为我们了阐明了人类和大多数动物细胞在分子水平上感受氧气含量的基本原理,揭示了氧气感知通路的信号机制,为贫血、心血管疾病、黄斑退行性病变以及肿瘤等多种疾病开辟了新的临床治疗途径。
2.我国围绕健康产业重点领域关键环节实施10项重大工程。国家发改委等多部门印发《促进健康产业高质量发展行动纲要(2019-2022年)》。到2022年,我国将围绕健康产业重点领域和关键环节实施10项重大工程,分别为优质医疗健康资源扩容工程、“互联网+医疗健康”提升工程、中医药健康服务提质工程、健康服务跨界融合工程、健康产业科技创新工程、健康保险发展深化工程、健康产业集聚发展工程、健康产业人才提升工程、健康产业营商环境优化工程、健康产业综合监管工程。
3.“4+7”试点将在全国推开。国家医保局等9部门联合发布《关于国家组织药品集中采购和使用试点扩大区域范围的实施意见》,意味着国家组织药品集中采购和使用试点(“4+7”试点)实施近半年后,将在全国范围内推开。试点扩围旨在推动解决试点药品在“4+7”试点城市与其他地区间价格落差较大的问题,让改革成果惠及更多群众;为全面开展药品集中带量采购积累经验;优化有关政策措施,保障中选药品长期稳定供应,引导医药产业健康有序和高质量发展。
审评动向
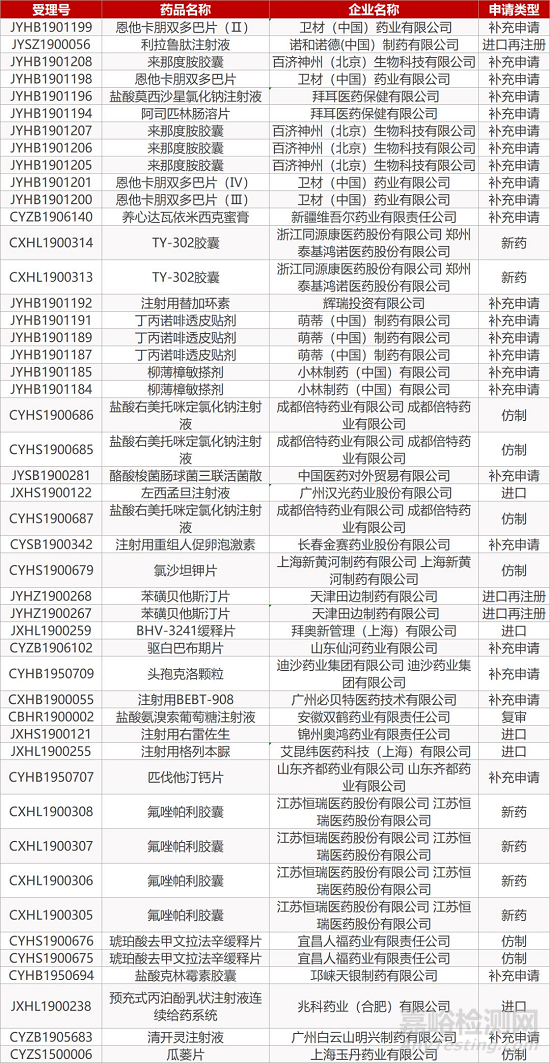
1. CDE最新受理情况(10月08日)
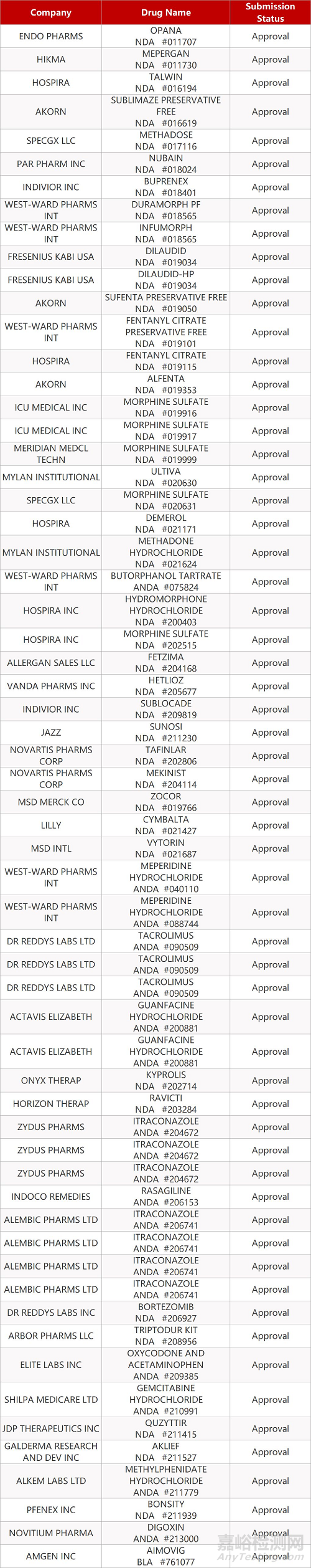
2. FDA最新获批情况(北美10月07日)

来源:药研发


